
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A.0.1mol氧化钠固体中离子个数为0.2NA
B.1mol金刚石中含C-C键的数目为4NA
C.标准状况下,22.4L乙炔中含π键数为2NA
D.1mol NaHSO4晶体中阳离子数为2NA
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.升高温度B.增大水蒸气浓度
C.加入大量CD.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,向![]()
![]() 的醋酸溶液中加入醋酸钠晶体,若混合液的
的醋酸溶液中加入醋酸钠晶体,若混合液的![]() ,则该溶液中
,则该溶液中![]()
B.根据下表中有关共价键的键能:
共价键 |
|
|
|
|
键能 | 348 | 610 | 413 | 436 |
可以计算出反应:![]()
![]()
![]()
![]() 的
的![]()
C.一定量的复盐![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,在某一时刻,反应的离子方程式可能是
溶液,在某一时刻,反应的离子方程式可能是![]()
D.已知:![]() ,
, ,向该温度下的饱和
,向该温度下的饱和![]() 溶液中加入一定量的硫酸钠或氯化钡固体后使
溶液中加入一定量的硫酸钠或氯化钡固体后使![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.可以根据![]() 和AgCl的Ksp的大小比较两者的溶解能力
和AgCl的Ksp的大小比较两者的溶解能力
B.常温下,同浓度的![]() 与NaHS溶液相比,NaHS溶液的pH大
与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的![]() 溶液和
溶液和![]() 溶液,后者的
溶液,后者的![]() 大
大
D.能使碘化钾淀粉试纸变蓝的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 等离子可以大量共存
等离子可以大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物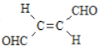 ,下列叙述正确的有( )
,下列叙述正确的有( )
A.分子间可形成氢键B.分子中既有极性键又有非极性键
C.分子中有7个![]() 键和1个
键和1个![]() 键D.C原子的杂化方式是sp2和sp3
键D.C原子的杂化方式是sp2和sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素或者化合物性质的比较中,正确的是![]()
![]()
A. 结构相似的分子晶体的熔沸点,与相对分子质量呈正相关,所以![]()
B. Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大
C. 在分子中,两个原子间的键长越长,键能越大
D. 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
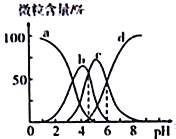
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(g)+nB(g)![]() pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
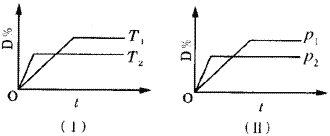
A.降温,化学平衡向正反应方向移动
B.使用催化剂可使D%有所增加
C.化学方程式中气体的化学计量数m+n>q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物同分异构体说法中错误的是
A. 三联苯(![]() )的一氯代物有4种
)的一氯代物有4种
B. 立方烷(![]() )经硝化可得到六硝基立方烷,其可能的结构有3种
)经硝化可得到六硝基立方烷,其可能的结构有3种
C. β-月桂烯(![]() )与溴发生1:1加成反应,产物(只考虑位置异构)有3种
)与溴发生1:1加成反应,产物(只考虑位置异构)有3种
D. 酯类化合物C4H8O2在酸性条件下水解得到的醇可能有4种不同结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com