
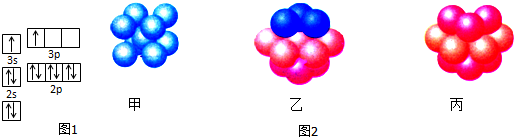
分析 A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,外围电子排布为ns2np3,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,应与水分子之间形成氢键,可推知A为N元素;B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,位于元素周期表的s区,原子核外电子排布式为1s22s22p63s2,则B为Mg元素;C元素原子的外围电子层排布式为nsn-1npn-1,s能级只能容纳2个电子,故n=3,则C为Si元素; D原子M能层为全充满状态,且核外的未成对电子只有一个,则原子核外电子数为2+8+18+1=29,故D为Cu,据此解答.
解答 解:A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,外围电子排布为ns2np3,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,应与水分子之间形成氢键,可推知A为N元素;B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,位于元素周期表的s区,原子核外电子排布式为1s22s22p63s2,则B为Mg元素;C元素原子的外围电子层排布式为nsn-1npn-1,s能级只能容纳2个电子,故n=3,则C为Si元素; D原子M能层为全充满状态,且核外的未成对电子只有一个,则原子核外电子数为2+8+18+1=29,故D为Cu,
(1)NCl3分子中N原子含有孤电子对=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,则N原子采取sp3杂化,为三角锥形结构,
故答案为:sp3;三角锥形;
(2)3p能级能量高于3s能级,应填充满3s能级再填充3p能级,违背能量最低原理,
故答案为:能量最低原理;
(3)非金属性越强,第一电离能越大,故第一电离能N>Si>Mg,C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则每个C形成的这3个键中,必然有1个双键,这样每个C原子最外层才满足8电子稳定结构,双键数应该是C原子数的一半,而每个双键有1个π键,显然π键数目为30,
故答案为:N>Si>Mg;30;
(4)Cu的基态原子核外电子排布式为1s22s22p63s23p63d104s1,1s、2s、2p、3s、3p、3d、4s能级能量不同,有7种能量不同的电子;Cu2+的价电子排布式为3d9;
Cu为面心立方最密堆积,是ABC型方式堆积,故为图乙结构;晶胞中Cu原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量=4×$\frac{64}{{N}_{A}}$g,该晶体中一个晶胞的边长为a cm,则晶胞体积=(a cm)3=a3 cm3,则Cu晶体的密度=(4×$\frac{64}{{N}_{A}}$g)÷a3 cm3=$\frac{4×64}{{a}^{3}•{N}_{A}}$g/cm3,
若Cu的原子半径为r,则晶胞棱长=4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,则晶胞体积=(2$\sqrt{2}$r)3,晶胞中Cu原子总体积=4×$\frac{4}{3}$πr3,则Cu晶胞这种堆积模型的空间利用率为$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$×100%,
故答案为:7;3d9;乙;$\frac{4×64}{{a}^{3}•{N}_{A}}$g/cm3;$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$×100%.
点评 本题是对物质结构的考查,题目综合性较大,涉及分子结构、杂化轨道、核外电子排布、电离能、晶胞计算等,是对学生综合能力的考查,(4)中晶胞空间利用率计算是难点、易错点,关键理解原子半径与晶胞棱长关系,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| C. | 含4.8g碳元素的石墨晶体中的共价键数为1.2NA个 | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
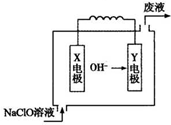
| A. | 镁作Y电极 | |
| B. | 电池工作时Na+向负极移动 | |
| C. | 废液的pH大于NaClO溶液的pH | |
| D. | X电极上发生的反应为:ClO-+2H2O-4e-═ClO3-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
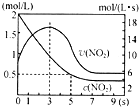 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: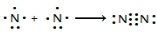 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
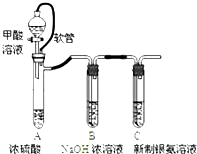 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 只有①②③ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | 离子半径:Y>Z>M | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM、YM都是电解质.熔融状态下都能导电 | |
| D. | 元素Z、M、R的离子均能破坏水的电离平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com