
研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
 ①SO2+NO2
①SO2+NO2 SO3+NO
SO3+NO
②SO3+H2O H2SO4
H2SO4
③2NO+O2 2NO2
2NO2
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入萤石中,加热 D.加入少量H2SO4使乙酸乙酯水解
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
常温下,向10mL 0.1mol•L﹣1NaOH溶液中逐滴加入0.1mol•L﹣1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是()

A. pH=7时,所加醋酸溶液的体积为10mL
B. pH<7时,溶液中:c(CH3COO﹣)>c(Na+)
C. 7<pH<13时,溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. 继续滴加0.1 mol•L﹣1醋酸溶液,溶液pH可以变为1
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是( )
A.只要在室内放一盆水
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用湿毛巾或蘸有石碱水的毛巾捂住口鼻撤离
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子( )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时, 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:

2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时, 与I-反应的离子方程式__________________________。
与I-反应的离子方程式__________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加 入到锥形瓶中。
入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是( )

A.甲是浓氨水,乙是浓硫酸 B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸 D.甲是浓硝酸,乙是浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+ I2+Z+H2O常作为Y的鉴定反应。
I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)_______。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_________________________________________________________________
___________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
___________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是__________________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)_____________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为 1g,MmRn质量为
1g,MmRn质量为 2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含
2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含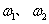 和a的代数式表示)。
和a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.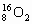 和
和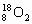 互为同位素,性质相似
互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、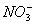 、
、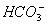 、Fe2+可以大量共存
、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s)△H>0,所以石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):

已知:a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子含10个电子,乙分子含18个电子。
(1)X的电子式是______________________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。

①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)________________________________________。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
______________________________________________________________________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电
子结构,丁的化学式是____________________。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是 ,Y是 ,Z是  。
。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是 。
(3)由X、Y、Z中的两种元素组成,且与X2Z分 子具有相同电子数的两种离子是 和 。
子具有相同电子数的两种离子是 和 。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com