
| A. | 铁棒附近产生OH- | B. | 铁棒质量减少 | ||
| C. | 石墨棒上放出氯气 | D. | 石墨棒上放出氧气 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X、Z两种元素可形成X2Z和X2Z2两种常见共价化合物 | |
| B. | M与Z形成的化合物的分子式为M2Z3 | |
| C. | 工业上可用电解熔融的W的氯化物的方法制取W的单质 | |
| D. | Z元素对应的单质与W元素对应的单质在不同条件下反应产物可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
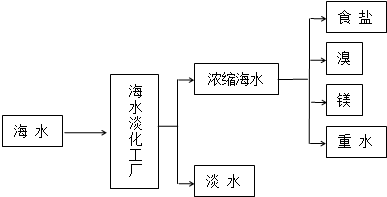
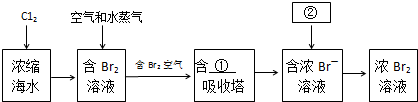
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含1mol HPE的溶液最多可以和2molNaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | 1molHPE能与4molH2发生加成反应 | |
| D. | HPE分子中最多有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把金属铁放入稀硫酸中 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3•H2O+BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
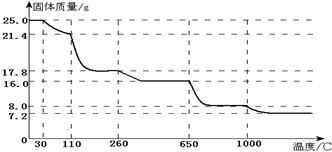
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com