
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.向100mL0.5mol·L-1Fe(NO3)3溶液中通入足量SO2气体,转移电子数为0.05NA
【答案】A
【解析】
A.铁发生吸氧腐蚀电极反应式:Fe2e=Fe2+,14.0gFe物质的量为![]() =0.25mol,转移电子数为:0.25mol×2×NA=0.5NA,故A正确;
=0.25mol,转移电子数为:0.25mol×2×NA=0.5NA,故A正确;
B.硫化氢为弱电解质,水溶液中不能完全电离,依据原子个数守恒可知:标准状况下,11.2LH2S物质的量为0.5mol,溶液中含硫粒子的数目等于0.5NA,故B错误;
C.pH=14的Ba(OH)2溶液中氢氧根离子浓度为1mol/L,0.5LpH=14的Ba(OH)2溶液含氢氧根离子物质的量为0.5mol,所以钡离子物质的量为0.25NA,故C错误;
D.100mL0.5mol·L-1Fe(NO3)3溶液中n(Fe3+)=0.05mol,n(NO3-)=0.15mol,通入足量SO2气体,Fe3+会被还原为Fe2+,NO3-会被还原为NO,转移电子数大于0.05NA,故D错误;
故答案选A。


科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家John B.Goodenough荣获2019年诺贝尔化学奖,他指出固态体系锂电池是锂电池未来的发展方向。Kumar等人首次研究了固态可充电、安全性能优异的锂空气电池,其结构如图所示。已知单位质量的电极材料放出电能的大小称为电池的比能量。下列说法正确的是
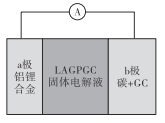
A.放电时,a极反应为:Al-3e-=A13+,b极发生还原反应
B.充电时,Li+由a极通过固体电解液向b极移动
C.与铅蓄电池相比,该电池的比能量小
D.电路中转移4mole-,大约需要标准状况下112L空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2固体(溶液体积变化、温度变化忽略不计),测得溶液中离子浓度的关系如图所示,下列说法正确的是( )
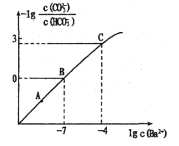
已知:Ksp(BaCO3)=2.40![]() 10-9
10-9
A.A、B、C三点对应溶液pH的大小顺序为:A>B>C
B.A点对应的溶液中存在:c(CO32-)< c(HCO3-)
C.B点溶液中 c(CO32-)=0.24mol/L
D.向C点溶液中通入CO2可使C点溶液向B点溶液转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:R—CH=CH2![]() R—CH2—CH2Br,则由2—溴丙烷制取少量的1—丙醇(CH3CH2CH2OH)时,需要经过的各反应分别为( )
R—CH2—CH2Br,则由2—溴丙烷制取少量的1—丙醇(CH3CH2CH2OH)时,需要经过的各反应分别为( )
A.加成→消去→取代B.取代→消去→加成
C.取代→加成→消去D.消去→加成→取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是( )

A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.在加热条件下,反应⑥的现象为产生砖红色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,可用于农药中间体以及有机磷水处理剂的原料。常温下向1L0.5mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是( )
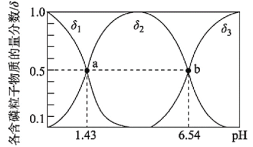
A.a、b两点,水分别电离出的c(OH-)水之比为10-6.54:10-1.43
B.b点对应溶液中存在:c(Na+)>3c(HPO32-)
C.当V(NaOH)=1L时,c(Na+)>c(H2PO3-)>c(H3PO3)>c(HPO32-)
D.反应H3PO3+HPO32-![]() 2H2PO3-的平衡常数为105.11
2H2PO3-的平衡常数为105.11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。回答下列问题:
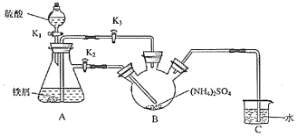
Ⅰ.制取莫尔盐:
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中__________(填仪器名称),将6.0g洁浄铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2molL-1稀硫酸后关闭K1.A装置中反应的离子方程式为______________。
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为___________________________________。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、___、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为_______________________________。
④装置C的作用为___________________,装置C存在的缺点是____________________。
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1molL-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mLKMnO4溶液。滴定反应的离子方程式为_______________________,该样品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物与Cu+结合形成如图所示的离子,则下列说法错误的是( )
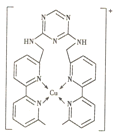
A.Cu+的核外电子排布式为[Ar]3d9
B.该离子中含有极性键、非极性键和配位键
C.该离子中碳原子的杂化方式有sp2、sp3两种
D.该离子中无手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com