
【题目】密封容器中发生可逆反应:X2+Y2![]() 2Z,已知起始时X2、Y2、Z的物质的量浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。反应在一定条件下进行到某一时刻时,各物质的物质的量浓度可能是( )
2Z,已知起始时X2、Y2、Z的物质的量浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。反应在一定条件下进行到某一时刻时,各物质的物质的量浓度可能是( )
A.c(X2)=0.2mol/LB.c(Y2)=0.35mol/LC.c(Y2)=0.2mol/LD.c(Z)=0.4mol/L
【答案】B
【解析】
A.若c(X)=0.2molL-1,则c(X)=0.1molL-1,反应消耗c(Z)=0.2molL-1,Z完全转化为反应物,不符合可逆反应的特征,A选项错误;
B.若c(Y2)=0.35molL-1,则c(Y2)=0.05molL-1,反应消耗c(Z)=0.1molL-1,还存在Z物质,符合可逆反应的特征,B选项正确;
C.若c(Y2)=0.2molL-1,则c(Y2)=0.1molL-1,反应消耗c(Z)=0.2molL-1,Z完全转化为反应物,不符合可逆反应的特征,C选项错误;
D.c(Z)=0.4molL-1,则c(Z)=0.2molL-1,反应消耗c(X)=0.1molL-1,X完全转化为生成物,不符合可逆反应的特征,D选项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·天津卷) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为69 ℃和58 ℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A. NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
B. NH3+HCl===NH4Cl
C. 2KOH+Cl2===KCl+KClO+H2O
D. 2K2O2+2CO2===2K2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法不正确的是 ( )
A. ①中MnO2和H2SO4都是氧化剂 B. ①中析出16gS时转移1 mol电子
C. ②中MnSO4发生氧化反应 D. 硫酸在该生产中可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图
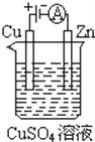
①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g)![]()
![]() CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s)+3CO(g )+SO2(g) ![]() CaS(s)+3CO2(g) ΔH=____________。
CaS(s)+3CO2(g) ΔH=____________。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________(填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
①在0~2min内的平均反应速率v(CO)=____________。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________(答出一条即可)。

(4)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是________(填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸的氧化性,用如图所示装置进行有关实验。

(1)装置A中发生反应的化学方程式为___,反应中体现了浓硫酸的___性和__性。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是___,其作用是___。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象时,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中的现象是___。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积的18molL-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
下列药品中能用来证明反应结束后的烧瓶中有余酸的是___(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行实验,下列有关说法正确的是( )
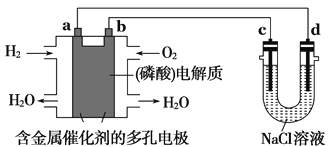
A. 电子流向为:电极a → 电极d →电极c →电极b
B. 电极b发生的电极反应为O2 + 2H2O + 4e- = 4OH-
C. 在电极a参与反应的气体体积在相同状况下与在电极c产生的气体体积为1:1
D. 为了防止大气污染,应在d端的U形管出口连接导管通入到NaOH溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com