
| A. | 2g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4 LO2含有的分子数目为NA | |
| C. | 1 molZn转变为Zn2+失去的电子数目为NA | |
| D. | 1 L 1mol•L-1KOH溶液中含有的钾离子数目为NA |
分析 A、氢气由氢原子构成;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、锌反应后变为+2价;
D、求出KOH的物质的量,然后根据1molKOH中含1mol钾离子来计算.
解答 解:A、氢气由氢原子构成,故2g氢气中含有的氢原子的物质的量n=$\frac{2g}{1g/mol}$=2mol即2NA个,故A错误;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氧气的物质的量小于1mol,故含有的分子数小于NA个,故B错误;
C、锌反应后变为+2价,故1mol锌失去2mol电子即2NA个,故C错误;
D、KOH的物质的量n=CV=1mol/L×1L=1mol,而1molKOH中含1mol钾离子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,熟练掌握公式的运用和物质的结构是解题关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )| A. | 1mol﹑2mol | B. | 4mol﹑4mol | C. | 4mol﹑2mol | D. | 4mol﹑1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c>d>b>a | B. | b>a>d>c | C. | a>b>c>d | D. | d>c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为: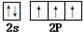 .
.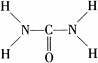 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯气溶于水:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com