
分析 (1)根据溶解所用到的仪器为:烧杯、玻璃棒;
(2)根据FeCl2易被空气中的氧气氧化成FeCl3,向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2;
(3)Cl2将FeCl2氧化生成FeCl3;
(4)检验溶解样品中含有Fe2+.滴几滴铁氰化钾试剂(或酸性高锰酸钾溶液),观察发生反应的现象判断;
(5)设FeCl3和FeCl2的物质的量分别为amol,bmol,结合铁元素守恒和氯元素守恒建立方程式组来求解.
解答 解:(1)溶解所用到的仪器为:烧杯、玻璃棒;FeCl2易被空气中的氧气氧化成FeCl3,向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2;故答案为:烧杯、玻璃棒;
(2)防止溶液里的Fe2+被氧化要加入铁粉,防止亚铁离子水解需要加入对应酸,实验室保存FeCl2溶液时通常会向其中加入少量试剂铁粉、盐酸,
故答案为:铁粉、盐酸;
(3)Cl2将FeCl2氧化生成FeCl3:Cl2+2FeCl2=2FeCl3,
故答案为:将Fe2+全部转化为Fe3+,Cl2+2FeCl2=2FeCl3;
(4)检验溶解样品中含有Fe2+.利用亚铁离子的特征性质滴几滴铁氰化钾试剂,产生蓝色沉淀证明亚铁离子的存在,利用亚铁离子的还原性,可以加入高锰酸钾溶液,紫红色褪去证明含亚铁离子,
故答案为:取少许样品溶解液于试管中,滴几滴铁氰化钾试剂(或酸性高锰酸钾溶液),若产生蓝色沉淀(溶液褪色),证明含有亚铁离子;
(5)FeCl3和FeCl2的物质的量分别为amol,bmol;
则有3amol+2bmol=$\frac{17.22g}{143,5g/mol}$=0.12mol(氯守恒)
amol+bmol=$\frac{4g}{160g/mol}$×2=0.05mol(铁守恒)
解得:a=0.02,b=0.03
固体样品中FeCl3和FeCl2的物质的量之比为2:3,
故答案为:2:3.
点评 本题主要考查了化学实验以及化学计算、实验基本操作、离子检验等,题目难度中等,注意在计算时抓住元素守恒列式计算.


科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2L CO2与SO2的混合物含有氧原子数为2NA | |
| B. | 常温下,0.9g H2O中,含有的电子数为0.5NA | |
| C. | 标准状况下,2.24L CCl4所含的原子数为0.5NA | |
| D. | 1mol•L-1的Na2SO4溶液中,含Na+的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与盐酸反应;有气泡逸出2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应;有白色沉淀生成Ba2++SO42-═BaSO4↓ | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生 HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 碳酸镁与盐酸反应:有气泡逸出CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
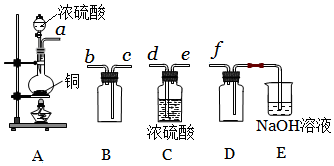
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(A)=0.15mol/(L•s) | D. | v(B)=0.9mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,电化腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,但不可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K 越大,反应物的转化率越小 | B. | K 与温度一定有关 | ||
| C. | K 与生成物的浓度一定有关 | D. | K 与反应物的浓度一定有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
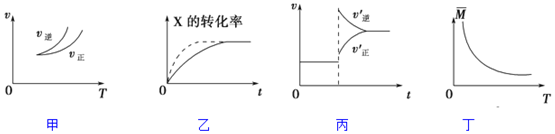
| A. | 依据图甲可判断正反应为吸热反应 | |
| B. | 在图乙中,虚线可表示压强增大 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com