
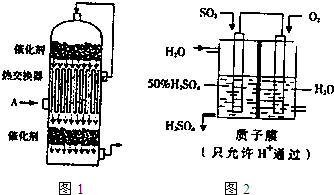
| 2mol |
| 4mol |
| c2(SO3) |
| c2(SO2)?c(O2) |
(
| ||||
(
|
| 100 |
| 9 |
| 2.24L |
| 22.4L/mol |
| 9.8g |
| 9.8g+x×1g/mL-1.8g |


科目:高中化学 来源: 题型:
| A、分子、原子、离子都是构成物的粒子 |
| B、由同种元素组成的物质不一定是纯净物 |
| C、含有氧元素的化合物称为氧化物 |
| D、含有羟基的有机物不一定属于醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下11.2LHCl |
| B、6.02×1023个CO2 |
| C、36gH2O(H2O的摩尔质量为18g?mol-1) |
| D、1.5molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物A的分子式为C3H6O2,B能发生银镜反应,有图示的转化关系,
化合物A的分子式为C3H6O2,B能发生银镜反应,有图示的转化关系,查看答案和解析>>
科目:高中化学 来源: 题型:
 ),有一定的致癌作用.对苯二胺属于
),有一定的致癌作用.对苯二胺属于查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com