
【题目】下列物质之间有如下反应关系:
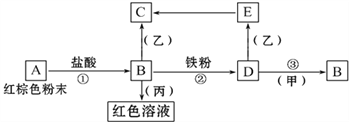
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
【答案】 Fe2O3 FeCl3 FeCl2 Cl2 NaOH KSCN 4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3
【解析】试题分析:(1)E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E为Fe(OH)2,C为Fe(OH)3,A为红棕色粉末,则A为Fe2O3,B为FeCl3,D为FeCl2,乙为NaOH,由D→B的转化可知,甲为氯气或氯水等,由血红色溶液可知,丙为KSCN,故填:Fe2O3;FeCl3;FeCl2;Cl2;NaOH;KSCN;
(2)E→C反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故填:4Fe(OH)2+O2+2H2O=4Fe(OH)3


科目:高中化学 来源: 题型:
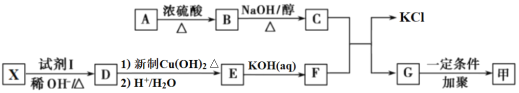
【题目】有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为:![]() 。由A、X为原料,按如下流程可以合成甲,其中试剂I可由一定条件下炔烃与水反应制得,试剂X的质谱图显示最大的峰值为106。
。由A、X为原料,按如下流程可以合成甲,其中试剂I可由一定条件下炔烃与水反应制得,试剂X的质谱图显示最大的峰值为106。
已知:a.—CH2OH+—CH2OH![]() —CH2OCH2—+H2O
—CH2OCH2—+H2O
b.![]() +
+![]() +H2O
+H2O
c.羟基直接连在碳碳双键的碳上是一种不稳定的结构,易发生分子内重排从而转化为稳定结构:![]()
请回答下列问题:
(1)已知A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积之比为2∶2∶1,则A的结构简式为___;
(2)下列说法不正确的是___;
A.有机物A能发生水解反应,其水解产物可用作汽车发动机的抗冻剂
B.有机物X不可能有能与Na单质发生置换反应的同分异构存在
C.有机物G的分子式为C13H14O3,能发生取代、加成、氧化、还原、加聚反应
D.有机物D分子内最多4原子共线,且所有原子均可能共面
(3)写出B→C的化学方程式:___;
(4)H是E的同分异构体,写出满足下列条件的H的结构简式___;
①1molH能与足量新制Cu(OH)2充分反应生成2molCu2O;
②H的核磁共振氢谱上共有四个吸收峰。
(5)聚乙酸乙烯酯(PVAc)是一种新型高分子材料,其性质稳定、无毒、粘结强度高,是一种环保的胶黏剂,设计由A为原料制备聚乙酸乙烯酯的流程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A结构如图。请回答下列问题:
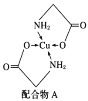
(1)写出基态Cu的外围电子排布式:__。
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是__;N2O与CO2互为等电子体,则N2O的空间结构为___。
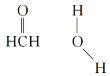
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醛分子中HCO的键角__(填“大于”“等于”或“小于”)120°;甲醛能与水形成氢键,请在如图中表示出来___。
(4)立方氮化硼如图1与金刚石结构相似,是超硬材料。立方氮化硼晶体内B—N键数与硼原子数之比为__。
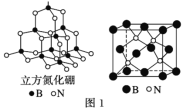
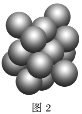
(5)Cu晶体的堆积方式如图2所示,设Cu原子半径为a,晶体中Cu原子的配位数为___,晶体的空间利用率为__。(已知:![]() ≈1.4)
≈1.4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞 (如图1)。
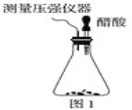
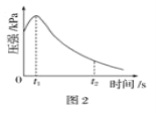
从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了____________腐蚀,此时,碳粉表面发生的电极反应式是____________。
(2)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是______。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的总反应式相同
(3)电动车采用了一种高效耐用的新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
①该电池放电时负极电极反应式为_________;
②充电时阳极电极反应式为_______。
(4)下列描述中,符合生产实际的是(______)
A. 电解食盐水制得金属钠 B. 电解熔融氯化铝制取金属铝,用石墨作阳极
C. 一氧化碳高温还原铁矿石制得铁 D.电解熔融氧化镁制取金属镁,用铁作阳极
(5)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)(______)
A.阴极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,可逆反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
A.单位时间内生成1molO2的同时,有2molSO3分解
B.混合气体的密度保持不变
C.混合气体的质量不再改变
D.SO2与SO3的体积比不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂。工业上由废铁生产FeSO47H2O的一种流程如图:
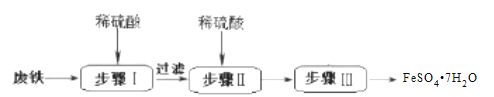
(1)步骤Ⅰ的操作前往往需要热碱溶液冲洗,其目的是_____。
(2)步骤Ⅰ加入稀硫酸的量不能过量的原因是_____。步骤Ⅱ加入稀硫酸的目的是_____。
(3)步骤Ⅲ从硫酸亚铁溶液中获得碱酸亚铁晶体(FeSO47H2O) 的实验操作为_____、_____、_____。烘干操作需在低温条件下进行,原因是_____。
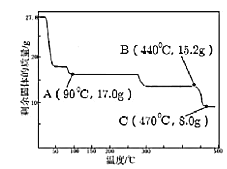
(4)取27.8g FeSO47H2O加热至不同温度,剩余固体的质量变化如上图所示。分析数据,90℃残留物的化学式是_____。440℃~470℃时固体物质发生反应的化学方程式是_____,做出这一判断的依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7溶液中存在下列平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
①H+ ②OH- ③K+ ④H2O
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示,已知有机物A,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种聚合物,生活中用于制造食物保鲜膜。

(1)写出B中官能团的电子式___;
(2)写出下列物质转化的化学方程式:
B→C:___;
B+D→E:___;
Ⅱ.(3)在实验室可以用如图2所示的装置进行B与D的反应,装置中通蒸气的导管要插在___溶液的液面上方,若要把制得的乙酸乙酯分离出来,应采用的实验操作是___。
Ⅲ.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图3所示:
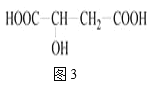
(4)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(5)在一定条件下,苹果酸可能与下列哪些物质发生反应___?
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com