
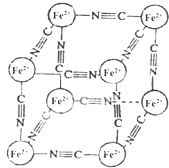
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中既有离子键又有极性共价键 | |
| B. | 晶体的化学式可表示为[M2Fe(CN)3] | |
| C. | M+离子位于晶胞体心 | |
| D. | 与每个Fe2+距离相等且最近的CN-有6个 |
分析 A.根据晶胞中微粒判断化学键类型;
B.根据晶胞中原子个数的计算方法为原子个数与被共用晶胞个数的倒数的乘积;然后根据化学式可以确定每个分子中含有几个晶胞;进而判断化学式和价态;
C.根据化学式中M+数目确定M+在晶胞中位置;
D.根据晶胞结构判断Fe2+配位数.
解答 解:A.晶胞中含有阴阳离子,含有离子键,氰根离子内C与N原子形成共价键,故A正确;
B.三价铁离子为角上,每个被八个晶胞共用,故每个晶胞中三价铁离子为4×$\frac{1}{8}$=0.5个,同理二价铁离子为0.5个,氰根离子位于边的中心,每个被四个晶胞共用,故每个晶胞中氰根离子为12×$\frac{1}{4}$=3个,已知化学式为:MxFey(CN)6,故化学式中,阴离子含有一个三价铁离子,一个二价铁离子,六个氰根离子,显示电中性,故晶体的化学式为MFe2(CN)6,故B错误;
C.由于晶胞中含有一个M+,只能位于体心,故C正确;
D.Fe2+位于顶点,与其距离相等且距离最近的,CN-位于棱心,Fe2+被8个晶胞共有,将棱边延长,被3条棱共有,每条棱有两个CN-距离相等且最近,则共有3×2=6,故D正确;
故选B.
点评 本题考查了晶体的晶胞中原子个数的计算方法,如何根据晶体个数判断晶体中的晶胞个数,判断化合价和晶体类型,判断晶体中相邻原子个数等知识点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 L庚烷完全燃烧所生成的气态分子数不是$\frac{7}{22.4}$NA | |
| B. | 28 g丙烯中含有的共用电子对数为6NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: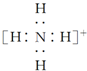 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:rX>rY>rW>rQ | |
| B. | 工业上常用电解的方法制备X,Y的单质 | |
| C. | 元素Q和Z能形成QZ2的共价化合物为原子晶体 | |
| D. | 元素X、Y的最高价氧化物对应水化物之间不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>0 | |
| B. | 每生成1mol水,转移8mol电子 | |
| C. | 氧化产物与还原产物的质量比为2:1 | |
| D. | N2H4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阿司匹林的分子式为C9H10O4 | B. | 阿司匹林属于有机高分子化合物 | ||
| C. | 1mol阿司匹林最多能与5molH2加成 | D. | 阿司匹林具有酸性,能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
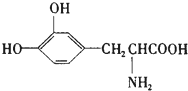
| A. | 只能与碱反应,不能与酸反应 | B. | 1mol该物质最多可与4molNaOH反应 | ||
| C. | 该物质不能使酸性KMnO4褪色 | D. | 1mol该物质最多可与1molHBr反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量增加 | B. | 溶液的温度降低 | ||
| C. | 晶体不再溶解 | D. | 溶液的温度和质量都不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com