
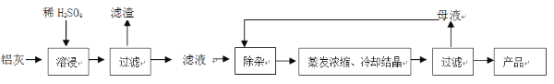
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
【答案】Al2O3+6H+=2Al3++3H2O 取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色 将Fe2+氧化为Fe3+ 调节pH值使铁完全沉淀 有黄绿色气体生成 MnO2+4HCl![]() MnCl2+ Cl2↑+2H2O 除去过量的
MnCl2+ Cl2↑+2H2O 除去过量的![]() K2SO4
K2SO4
【解析】
根据工艺流程分析可知,铝灰加稀硫酸酸浸后,Al2O3和铁的氧化物溶解,过滤得到SiO2的滤渣和含有Al3+、Fe3+、Fe2+的滤液,除杂后冷却结晶再过滤,得到产品,据此分析解答问题。
(1)硫酸溶解氧化铝的离子方程是属于基础题,该离子方程式为A12O3+6H+=2A13++3H2O;
(2)由于在上述流程中,所得的滤液既含有亚铁离子,又含有铁离子,因此二者共存时要检验亚铁离子应该用酸性高锰酸钾溶液检验,避免使用KSCN;所以操作方法为:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色;
(3)①除杂步骤中加入高锰酸钾就是要加入氧化剂,把亚铁离子氧化为铁离子,在调节pH值到3.2,好让铁离子完全沉淀除去,同时不使其他离子沉淀;
②若步骤II所得的沉淀中含有二氧化锰,则往沉淀中加入浓盐酸,则会发生我们熟悉的实验室制备氯气的反应,因此可以观察到有黄绿色气体产生,方程式为MnO2+4HCl= MnCl2+Cl2↑+2H2O;
③步骤II所得的上层溶液显紫红色,所以溶液中含有![]() ,
,![]() 可与Mn2+反应生成MnO2 ,所以加入MnSO4的目的是出去过量的
可与Mn2+反应生成MnO2 ,所以加入MnSO4的目的是出去过量的![]() ;
;
(4)除杂步骤除去了杂质离子,不断循环后,循环液中含有大量的高锰酸钾反应剩下的钾离子,同时加入了MnSO4,所以还剩有硫酸根离子;因此主要物质是硫酸钾。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.一定条件下,使用催化剂能加快反应速率和提高反应物转化率
B.常温下,向水中滴加少量酸形成稀溶液,溶液中![]() 和水的离子积常数
和水的离子积常数![]() 均不变
均不变
C.在锌与足量稀硫酸反应溶液中加入少量硫酸铜溶液,可以加快反应速率但不影响产生氢气的量
D.在密闭绝热的容器中发生![]() 反应,当反应容器温度恒定时,反应达到平衡
反应,当反应容器温度恒定时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以“火法粗炼”、“电解精炼”相结合的炼制精铜工艺流程如下:
![]()
已知“还原”反应中,冰钢中的![]() 先转化为
先转化为![]() ,然后
,然后![]() 再与
再与![]() 反应生成粗铜。下列叙述正确的是( )
反应生成粗铜。下列叙述正确的是( )
A.该炼铜工艺对环境友好,不会产生大气污染物
B.“焙烧”过程中,![]() 既是氧化剂又是还原剂
既是氧化剂又是还原剂
C.在![]() ”还原”为Cu的总反应中,
”还原”为Cu的总反应中,![]() 作催化剂
作催化剂
D.“电解”时,金、银等贵金属被置换出来形成阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2SO4(s)+SO2(g)![]() [N(CH3)4]2S2O6(s)
[N(CH3)4]2S2O6(s)
下列说法正确的是
A.[N(CH3)4]+中只含共价键
B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性
D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2S2O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.![]() 含有的电子数为NA
含有的电子数为NA
B.标准状况下,![]() 的
的![]() 中含有的氯原子数为0.4NA
中含有的氯原子数为0.4NA
C.常温常压下,![]() 葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA
葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA
D.标准状况下,![]() 的乙烯所含碳原子的个数为0.4NA
的乙烯所含碳原子的个数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
利用Kolbe's电解法制取乙炔的反应原理为: +2H2O
+2H2O 2CO2↑+C2H2↑+H2↑+2KOH
2CO2↑+C2H2↑+H2↑+2KOH
【1】下列表示反应中相关微粒的化学用语错误的是( )
A.中子数为20的钾原子:![]() K
K
B.K+的结构示意图:
C.CO2的电子式:![]()
D.C2H2的结构式:H—C![]() C—H
C—H
【2】有关该反应的下列说法正确的是( )
A.化学能转变为电能
B.电解槽中向阴极迁移的主要是H+
C.电解过程中溶液pH不断减小
D.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
【3】下列羧酸钾盐中,其水溶液电解生成的烃主要是CH2=CH2的是( )
A.CH3COOKB.CH3CH2COOKC.CH2=CHCOOKD.KOOCCH2CH2COOK
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com