
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为 ;
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。

【答案】(1)16H++5H2C2O4+2MnO4 -=2Mn2++10CO2↑+8H2O (2)②③;①② (3)0.010或1.0×10-2
(4)
【解析】
试题分析:(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,则离子方程式为16H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O,故答案为:16H++5H2C2O4+2MnO4 -=2Mn2++10CO2↑+8H2O;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②,故答案为:②和③; ①和②;
(3)草酸的物质的量为:0.10mol•L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol•L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:(0.010mol/L×0.004L)÷(0.002L+0.004L)= ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)= ×0.010mol/L÷40s/60s/min=0.010mol•L-1•min-1,故答案为:0.010或1.0×10-2;
×0.010mol/L÷40s/60s/min=0.010mol•L-1•min-1,故答案为:0.010或1.0×10-2;
(4)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为:,故答案为:。
考点:考查探究温度、浓度对反应速率的影响、浓度随时间变化的曲线


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,则下列说法不正确的是( )
A. 1mol氯气参加氧化还原反应时电子转移2NA
B. 3.2gSO2与2.3gNO2所含有的氧原子数相等
C. 1molNa2O2与足量水反应后转移的电子数为NA
D. 1L0.1mol/LMgCl2溶液中Cl—离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E,原子序数依次增大。已知元素A的气态氢化物和A的最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈的金属元素。下列叙述不正确的是
A.元素A的氧化物常温下一般均为无色无味气体
B.元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应
C.原子半径:C>D>B
D.元素B的气态氢化物的沸点比元素E气态氢化物的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Li、Na、K、Rb、Cs的叙述均正确的一组是
①金属性最强的是铯
②它们的氧化物都只有M2O和M2O2两种形式
③在自然界中均以化合态形式存在
④密度按Li—Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+
A.①②③ B.①③④⑤ C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
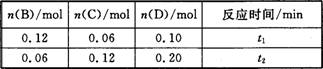
下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活密切相关,下列说法正确的是( )
A. 纳米材料直径一般在几纳米到几十纳米(1nm=10﹣9m)之间,因此纳米材料属于胶体
B. 青铜是我国使用最早的合金
C. SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
D. 明矾与漂白粉都是水处理药品,原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应所得的溶液中一定只含一种溶质的是( )
|
| A. | 向硫酸酸化的Fe2(SO4)3溶液中加入过量的Ba(OH)2溶液 |
|
| B. | 向AlCl3溶液中加入过量的氨水 |
|
| C. | 向NaOH溶液中通人CO2气体 |
|
| D. | 将过量的Cu粉加入FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
Ⅰ、热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B | C |
| 反应物投入量 | 1molCO2(g)和 3molH2(g) | 1molCH3OH(g)和 1molH2O(g) | 2molCO2(g)和6mol H2(g) |
| CH3OH(g)浓度(mol/L) | c1 | c2 | c3 |
| 反应能量变化 | 放出29.4kJ | 吸收a kJ | 放出b kJ |
①从反应开始到达平衡时,A中用CO2来表示的平均反应速率为 0.03 mol/(L•s)(用具体数值表示)
②a= 19.6 .c1 = c2 < 1/2c3(填“>”“<”或“=”).
Ⅱ、CO可用于合成甲醇.在压强0.1MPa条件下,向体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图1所示

(1)该反应属于反应 放热 (填“吸热”或“放热”);P2 > 0.1MPa(填“>”“<”或“=”)
(2)100℃时,该反应的平衡常数K= 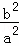 (用含a、b的代数式表示)
(用含a、b的代数式表示)
Ⅲ、碳一化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.CO与NO在催化剂的条件下反应如下:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0,在绝热、恒容的密闭容器中加入一定量的NO和CO发生上述反应,图2的示意图不能说明反应在进行到t1时刻达到平衡状态的是 c (填字母序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
碳纳米管是近年来材料科学研究的热点.为除去碳纳米管中的杂质﹣﹣碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体.以下判断正确的是( )
|
| A. | 可以用浓盐酸调节K2Cr2O7溶液的酸性 |
|
| B. | 该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子 |
|
| C. | 若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极 |
|
| D. | 可以通过过滤的方法最终得到碳纳米管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com