
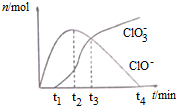
| A. | t1时,溶液中Na+、NH4+、CO32-、S2-可以大量共存 | |
| B. | t2时,溶液中含氯微粒浓度大小:c(ClO-)>c(Cl-)>c(ClO3-) | |
| C. | t3时,离子方程式为:4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O | |
| D. | t4时,因c(ClO-)接近于0,所以c(ClO3-)=c(Cl-) |
分析 A.t1时,溶液中存在大量次氯酸根离子,次氯酸根离子能够氧化硫离子;
B.根据图象可知,t2时c(ClO-)>c(ClO3-),根据电子守恒可知c(Cl-)>c(ClO-);
C.t3时,c(ClO-)=c(ClO3-),根据电子守恒写出该反应的离子方程式;
D.t4时,c(ClO-)接近于0,根据电子守恒可知n(Cl-)=5n(ClO3-).
解答 解:A.t1时,溶液中存在大量的ClO-,ClO-具有强氧化性,能够氧化S2-,在溶液中不能大量共存,故A错误;
B.t2时c(ClO-)>c(ClO3-),氯气转化成次氯酸根离子、硫酸根离子时,化合价分别升高1价、5价,氯气转化成氯离子时化合价降低1价,根据电子守恒可知:n(Cl-)=n(ClO-)+5n(ClO3-),则c(Cl-)>c(ClO-),故离子浓度大小为:c(Cl-)>c(ClO-)>c(ClO3-),故B错误;
C.t3时,c(ClO-)=c(ClO3-),根据B的分析可知,n(Cl-)=n(ClO-)+5n(ClO3-),则该反应的离子方程式为:4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O,故C正确;
D.根据电子守恒可知:n(Cl-)=n(ClO-)+5n(ClO3-),t4时c(ClO-)接近于0,则n(Cl-)=5n(ClO3-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较、氧化还原反应的计算,题目难度中等,涉及离子共存的判断、氧化还原反应中电子守恒的计算及判断、离子浓度大小比较等知识,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 由于浓HNO3和浓H2SO4氧化性均较强,常温下都不可用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热煮沸 | B. | 向水中投入一小块金属钠 | ||
| C. | 向水中通入二氧化硫气体 | D. | 向水中加食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 随核电荷数递增,同主族元素的简单阴离子还原性递增减 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com