
【题目】![]() 、
、![]() 混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的
混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的![]()
A. 加入 KSCN的溶液一定不变红色B. 溶液中一定含有![]()
C. 溶液中可能含![]() D. 剩余固体中一定有铜
D. 剩余固体中一定有铜
【答案】B
【解析】
Fe3+的氧化性强于Cu2+,加入铁粉,根据氧化还原反应中先后规律,反应前后Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu或者Cu+2Fe3+=2Fe2++Cu,然后进行分析;
Fe3+的氧化性强于Cu2+,加入铁粉,根据氧化还原反应中先后规律,反应先后先后胡顺序Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu或者Cu+2Fe3+=2Fe2++Cu,
A、因为有固体存在,该固体可能是Fe、Cu的混合物、也可能是Cu,无论哪种哪种情况,得出溶液中一定不含有Fe3+,因此加入KSCN溶液后,溶液不变红,故A说法正确;
B、根据A选项分析,故B说法错误;
C、如果铁粉与Cu2+反应,铁粉不足,溶液中有Cu2+,固体为Cu单质,也符合题意,故C说法正确;
D、根据上述分析,剩余固体中一定含有铜,故D说法正确。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。下列叙述正确的是( )
A. 用带玻璃瓶塞的试剂瓶盛放NaOH溶液
B. 硅是地壳中含量最多的元素
C. SiO2不溶于水也不溶于任何酸
D. 晶体硅是良好的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,试回答下列问题:
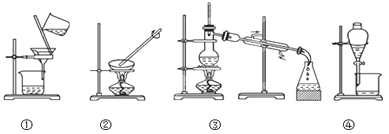
(1)图中③实验操作的名称是__________________;
(2)写出装置④中所用玻璃仪器的名称____________________,____________________;
(3)下列实验需要在哪套装置中进行(填序号):
a、从海水中提取蒸馏水:____________,
b、分离氯化钠和水:________________,
c、分离碳酸钙和水:________________,
d、分离植物油和水:________________;
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设为阿伏伽德罗常数的值,下列叙述正确的是![]()
A. 18gH2O中所含的电子数为NA
B. 标准状况下,22gCO2与11.2LH2O含有相同的原子数
C. 常温常压下,48gO2与O3的混合气体中含有的原子总数为3NA
D. 2L0.1mol/LNa2CO3溶液中所含Na+的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)。
实验序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
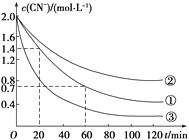
(2)实验①中20~60 min时间段反应速率:v(CN-)=______mol·L-1·min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是____________________(填一点即可)。在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO,同时放出NH3,试写出该反应的离子方程式:____________。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他们设计实验并验证上述结论,完成下表中内容(已知:废水中的CN-浓度可用离子色谱仪测定) ______。
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】6-硝基胡椒基酸K是合成心血管类药物米络沙星的中间体,在实验室中合成路线如下图所示(部分反应条件已经略去):
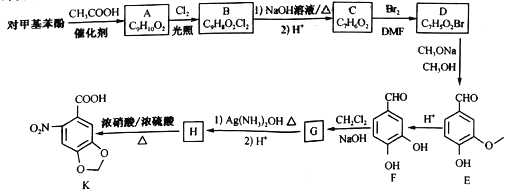
已知:连在同一个碳上的两个羟基易脱水形成羰基。
回答下列问题:
(1)C的名称为_______,H 中官能团的名称为__________。
(2)由C生成D的反应类型为_______,G 的结构简式为_______ 。
(3)由A生成B的化学方程式为_______ 。
(4)R是E的同分异构体,R中有两个取代基,其中一个为羟基且与苯环直接相连,另一个取代基含有“![]() ”,符合条件的R有_____种。其中核磁共振氢谱显示有5种不同类型的氢,且峰的面积之比为2 :2 :2: l: 1的同分异构体的结构简式为________。
”,符合条件的R有_____种。其中核磁共振氢谱显示有5种不同类型的氢,且峰的面积之比为2 :2 :2: l: 1的同分异构体的结构简式为________。
(5)写出以邻苯二酚![]() 和乙醇为原料制备
和乙醇为原料制备![]() 的合成路线____________(其他无机试剂任选)。
的合成路线____________(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)甲醇熔融碳酸盐电池是一种新型燃料电池,该电池以熔融的Na2CO3为电解质,写出该电池负极的电极反应式:_____________________________
(2)恒容条件下,能表明反应I达到化学平衡状态的是________。
a.混合气体的密度不变 b.反应容器中甲醇的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)反应Ⅱ的△H2=__________。
(4)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,温度为500℃时,该反应10 min时达到平衡,CO2的平衡转化率为60℅,用H2表示该反应的速率为____________。
(5)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
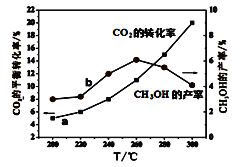
据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. O2 的摩尔质量是32 g
B. 1 mol Na2O 的质量一定是62 g
C. 1 mol·L-1的NaCl 溶液约含有Na+数目为6.02×1023
D. 1 mol NO2气体在标况下的体积一定是22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com