
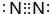 ;
;分析 处于同一短周期的A、B、C、D四种主族元素,B元素基态原子的最外层有3个未成对电子,次外层有2个电子,则B原子核外电子排布式为1s22s22p3,故B为N元素;A的原子半径最小,则A为F元素;C的电负性介于F、N之间,则C为O元素;D与B相邻,则D为碳元素,据此解答.
解答 解:处于同一短周期的A、B、C、D四种主族元素,B元素基态原子的最外层有3个未成对电子,次外层有2个电子,则B原子核外电子排布式为1s22s22p3,故B为N元素;A的原子半径最小,则A为F元素;C的电负性介于F、N之间,则C为O元素;D与B相邻,则D为碳元素.
(1)B元素形成单质分子为N2,电子式为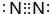 ,故答案为:
,故答案为: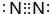 ;
;
(2)A、B、C、D四种元素形成的电子数相同的四种氢化物为HF、NH3、H2O、CH4,前三种分子之间均含有氢键,甲烷分子之间为范德华力,故沸点最低的是CH4,F元素非金属性最强,故稳定性最强的是 HF,甲烷为正四面体对称结构,为非极性分子,其它三种为极性分子,NH3、H2O、CH4中心原子的杂化轨道数目均为4,中心原子均为sp3杂化,
故答案为:CH4;HF;CH4;是;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能N>O>C,
故答案为:N>O>C;
(4)HF与H2O均为极性分子,相似相溶,HF与H2O之间形成氢键,故HF易溶于水,
故答案为:HF与H2O均为极性分子,相似相溶,HF与H2O之间形成氢键.
点评 本题考查结构性质位置关系应用、元素周期律、分子结构与性质等,注意同周期主族元素第一电离能异常情况.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
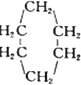 可表示为
可表示为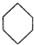 ,下面是某高聚物的合成路线,试完成下列试题:
,下面是某高聚物的合成路线,试完成下列试题: $→_{Ⅰ}^{NH}$
$→_{Ⅰ}^{NH}$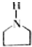 $→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$
$→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$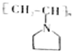
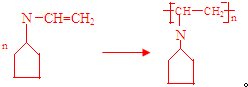 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | nCH2═CH2-→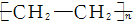 | B. | CH2═CH2+HCl-→CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH2CHO+2H2O | D. | 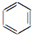 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$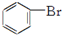 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-、AlO2-、Na+ | B. | Na+、CO32-、AlO2- | C. | CO32-、Na+、Al3+ | D. | MnO4-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 150mL | C. | 200mL | D. | 250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
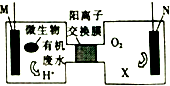 为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 该装置工作时,H+从右侧经阳离子交换膜移向左侧 | |
| C. | 负极的电极反应为:(C6H10O5)n+7H2O-24ne-═6nCO2↑+24nH+ | |
| D. | 物质X是OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △H1=△H3>△H2 | D. | △H2=△H3<△H1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com