
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常见物质,利用这些物质能完成的实验是
①白酒中是否含甲醇 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸( )
A. ①② B. ①③ C. ①②③ D. ②③
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如图所示: 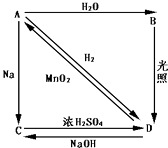
(1)分别写出下列物质的化学式:
BD
(2)试写出有关化学方程式:
A→B
D→A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2(g)+I2(g)2HI(g)已经达到平衡状态的标志是( )
①c(H2)=c(I2)=c(HI)
②c(H2):c(I2):c(HI)=1:1:2
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成nmolH2的同时生成2nmolHI
⑤单位时间内生成n mol H2的同时生成n mol I2
⑥反应速率v(H2)=v(I2)= ![]() v(HI)
v(HI)
⑦一个H﹣H键断裂的同时有两个H﹣I键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
条件一定,混合气体的平均相对分子质量不再变化.
A.5项
B.4项
C.3项
D.2项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
3A(g)+B(g)2C(g)+D(g)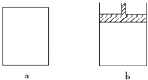
(1)达平衡时,a中A的浓度为M molL﹣1 , C的浓度为N molL﹣1 , b中A的浓度为m molL﹣1 , C的浓度为n molL﹣1 , 则Mm;Nn; (填“>”或“<”或“=”或“无法比较”)
(2)保持温度不变,按下列配比分别充入 a、b 两容器,达平衡后a中C的浓度为N molL﹣1的是 , b中C的浓度为n molL﹣1的是
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1mol D
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
(3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为WmolL﹣1 , C的浓度为YmolL﹣1 , 则W和M,Y和N之间的关系为WM、YN. (填>、<、=、无法比较)
(4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为R molL﹣1 , 则关系式正确的是
A.R=2M
B.R<M
C.M<R<2M
D.R>2M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH 溶液中逐滴加入AlCl3溶液,生成沉淀A1(OH)3的量随AlCl3加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是
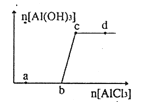
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因:______________________________。
②在NaHA水溶液中各离子浓度的大小关系是:______________________________。
(2)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K=______。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法与社会可持续发展理念相符合的是
A.推广一次性塑料袋的使用
B.应用高效洁净的能源转换技术
C.加快化石燃料的开采与使用
D.大量开采地下水以满足工业生产需求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法正确的是
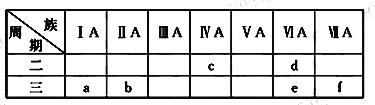
A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. c、e、f的最高价氧化物对应的水化物的酸性依次增强
D. 六种元素中,c元素单质的化学性质最活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com