
|
常温下,将1.92 g铜加入到100 ml H2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448 ml(标准状况)的氢气.下列有关结论不正确的是 | |
| [ ] | |
A. |
溶解的铁粉为2.8 g |
B. |
原溶液中C(SO42-)=0.5 mol/L |
C. |
原混合溶液中C(H+)=1.2 mol/L |
D. |
原溶液中n(NO3-)=0.08 mol |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
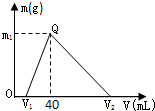 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL C(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL C(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市泗水一中高一上学期期末模拟化学试卷(带解析) 题型:单选题
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200 mL C(OH-)= 0.1mol/L的溶液,然后逐滴加入1 mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是 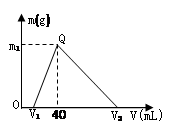
| A.原合金质量为 0.92 g |
| B.图中V2为 60 |
| C.整个加入盐酸过程中 Na+的浓度保持不变 |
| D.Q点m1为1.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com