
 Al-H202电池功率大,可作为许多机械的动力电池,其结构如图所示.下列说法不正确的是( )
Al-H202电池功率大,可作为许多机械的动力电池,其结构如图所示.下列说法不正确的是( )| A、铝作负极,电池工作时将不断溶解 |
| B、该电池不是二次电池,不可充电 |
| C、碳纤维电极的电极反应是H202+2e-+2H+=2H2O |
| D、电池工作时OH-从碳纤维电极透过离子交换膜移向Al电极 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
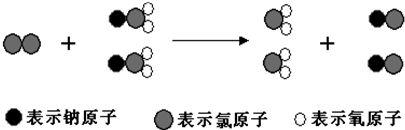
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、仅③ |
| C、①④ | D、均正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2O2Cl4 |
| B、KCl?MgCl2?6H2O |
| C、KMnO4 |
| D、Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、直流电源A为正极、B为负极 |
| B、当电解过程中质子从Pt电极向Ag-Pt电极移动 |
| C、在阳极发生的电极反应:2H2O-4e-=O2+4H+ |
| D、当电解过程转移2mol电子时,阴极室质量减少5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石和富勒烯(C60) |
B、CH3CH2CH2CH3和 |
| C、12CO和14CO |
| D、CH3CH3 和CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com