
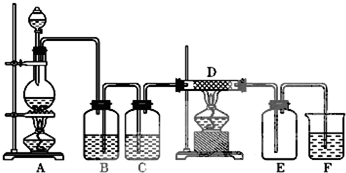
���� ��1��ϴ��ƿϴ��ʱ��������Ӧ����Һ�����£���ѭ�����̳����ɣ�
��2������Ũ�����ӷ������ʣ��������������ʵijɷּ����ʣ�ѡ����ʵij��Ӽ���
��3������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ������������Ӧ�����Ȼ�����
��4�����ݷ���ʽMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+2H2O+Cl2�����μӷ�Ӧ���Ȼ���Ϊ4molʱ��ֻ��2mol������������1mol�������ݴ˼����������3.36L����״���������������Ȼ�������ʵ�����
��� �⣺��1��Bװ���dz�ȥ�����к����������Ȼ��⣬װ���е��ܶ̽�������ϴ��װ�ó�����Ҫ��ѭ�����̳�������Bװ�ô���
�ʴ�Ϊ��B��
��2��Ũ������лӷ��ԣ��Ʊ��������к����Ȼ����ˮ�����������ڱ���ʳ��ˮ���ܽ�Ȳ����Ȼ���������ˮ�����Կ���ѡ��װ�б���ʳ��ˮ��װ��B��ȥ�����е��Ȼ��⣬Ũ���������ˮ�ԣ�������װ��Ũ�����C��ȥ�����е�ˮ������
�ʴ�Ϊ����ȥ�����е��Ȼ��⣻Ũ���
��3������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ�����ӷ���ʽ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O������������Ӧ�����Ȼ�������ѧ����ʽ��2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3 ��
�ʴ�Ϊ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3 ��
��4������3.36L����״���������ʵ���Ϊ��$\frac{3.36L}{22.4L/mol}$=0.15mol�����ݷ���ʽMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+2H2O+Cl2�����μӷ�Ӧ���Ȼ���Ϊ4molʱ��ֻ��2mol������������1mol������������0.15mol����ʱ����0.3mol������������
�ʴ�Ϊ��0.3mol��
���� ���⿼����������ʵ�����Ʊ�ԭ����װ�á���������Ĵ������йط���ʽ�ļ��㣬�����������仯���������ǽ��Ĺؼ�����Ŀ�ѶȲ���


 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
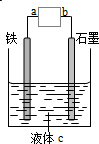
| A�� | a��b�ӵ���������װ��Ϊԭ��� | |
| B�� | a��b��ֱ����Դ����װ��Ϊ���� | |
| C�� | a��b��ֱ����Դ�������ܲ��ױ���ʴ | |
| D�� | a��b�ӵ��������ֱ����Դ�����������Ǹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
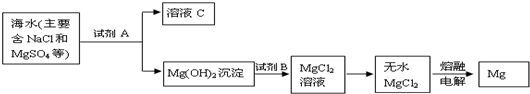
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij�¶�ʱ��KW=10-12�����¶���PH=6����Һһ�������� | |
| B�� | 25��ʱ��0.1mol/L��NaHSO3��ҺpH=4��˵��HSO3-��ˮ��Һ��ֻ���ڵ��� | |
| C�� | NH4Cl��CH3COONa��NaHCO3��NaHSO4����ˮ����ˮ�ĵ��붼�дٽ����� | |
| D�� | ϡ�� 0.1mol/L CH3COONa��Һ�����У�c��OH-��/c��CH3COO-������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
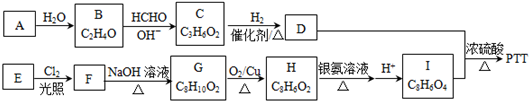
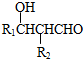
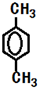 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ƽ��ȡ28.6g Na2CO3•10H2O���� | |
| B�� | ��Na2CO3�����������ƿ�У���ˮ���̶��� | |
| C�� | ����ʱ����Һ�棬������ҺŨ��ƫ�� | |
| D�� | ��ˮʱ���������̶��ߣ��ý�ͷ�ι�ֱ����������Һ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com