
 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.分析 (1)反应物为Na2SO4和CH4,产物之一为Na2S,利用原子守恒推断其他产物并配平化学方程式;
(2)根据化合价的变化,化合价降低的元素所在的物质是氧化剂,硫酸铜中的铜由+2价变成+1价;当产生标准状况下44.8L SO2时,转移电子的物质的量为2mol,由此分析判断;
(3)放电是原电池原理,原电池中阳离子向正极移动;放电过程中正极发生还原反应;
(4)单质铁要转化为Na2FeO4,所以铁作为电解池的阳极,发生氧化反应;
(5)根据二氧化硫和硫酸铁反应,根据二价铁和高锰酸钾反应的方程式进行解答.
解答 解:(1)硫酸钠变为硫化钠时,硫元素由+6价降为-2价,由此推断甲烷中碳元素的化合价升高,由-4价升为+4价,生成CO2,根据最小公倍数法配平可得反应式CH 4+Na2SO4 $\frac{\underline{\;催化剂\;}}{高温}$Na 2S+CO2+2H 2O,故答案为:CH 4+Na2SO4 $\frac{\underline{\;催化剂\;}}{高温}$Na 2S+CO2+2H 2O;
(2)根据化合价的变化,化合价降低的元素所在的物质是氧化剂,硫酸铜中的铜由+2价变成+1价,所以硫酸铜是氧化剂;当产生标准状况下44.8L SO2时,转移电子的物质的量为2mol,则产生标准状况下2.24 L SO2时,转移0.1 mol电子,故答案为:CuSO4;0.1;
(3)放电过程中阳离子向正极移动,阴离子向负极移动,所以放电过程中钠离子从负极到正极,即从右到左,正极反应式为:Br3-+2e-═3Br-,
故答案为:从右到左;Br3-+2e-═3Br-;
(4)单质铁要转化为Na2FeO4,所以铁作为电解池的阳极,发生氧化反应,所以电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O,
故答案为:阳;Fe-6e-+8OH-═FeO42-+4H2O;
(5)根据FeS2~2SO2、SO2~2Fe3+~2Fe2+、5Fe2+~MnO4-,可得关系式:5FeS2~4MnO4-,则样品中FeS2的质量为:0.020 0 mol•L-1×0.025 L×$\frac{5}{4}$×120 g/mol=0.075 g,样品中FeS2的质量分数为$\frac{0.075g}{0.1000g}$×100%=75%,故答案为:75%.
点评 本题考查化学方程式的书写、氧化还原反应中氧化剂和还原剂的判断和电子的转移以及电化学的相关知识,综合性强,有一定的难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
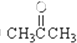 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤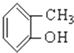 ⑥
⑥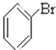 ⑦
⑦ ⑧
⑧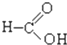 ⑨
⑨ ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
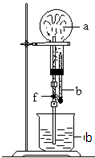 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4mol•L-1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol•L-1盐酸 |
| A. | ①和② | B. | ③和④ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的分子式 | B的分子式 | VA:VB |
| ① | C4H10 | C3H6 | 3:2 |
| ② | C4H10 | C2H4 | 4:1 |
| ③ | C4H10 | C2H2 | 4:1 |
| ④ | C4H10 | C3H4 | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液能导电 | B. | 易溶于水 | C. | 熔化时能导电 | D. | 有较高的熔点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com