
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 10.0 | 8.4 | 3.7 | 6.7 |
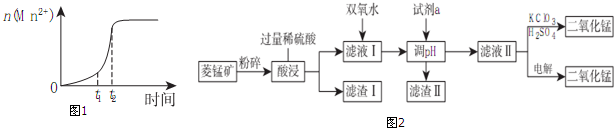
分析 (1)KMnO4溶液的pH=7,说明HMnO4溶液是强酸,根据pH=-lg(H+)来计算;
(2)菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入试剂双氧水,将溶液中Fe2+氧化为Fe3+,加入试剂a为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,铜离子转化为氢氧化铜沉淀,过滤除去,滤液2中加入试剂硫酸和氯酸钾,3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl,根据电解原理进行回答判断.
(3)根据方程式和化合价的升降情况进行计算.
解答 解:(1)KMnO4溶液的pH=7,说明HMnO4溶液是强酸,0.01mol/LHMnO4溶液pH=-lg(H+)=2;一定温度下将酸性KMnO4溶液与草酸溶液混合在一起后,根据溶液内n(Mn2+)随时间变化可以看出:反应生成的Mn2+对反应起催化作用;故答案为:2;反应生成的Mn2+对反应起催化作用;
(2)①加入试剂a为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,铜离子转化为氢氧化铜沉淀,滤渣Ⅱ的成分是Cu(OH)2、Fe(OH)3;向滤液中加入试剂双氧水,将溶液中Fe2+氧化为Fe3+,发生反应:2Fe2++H2O2+2H+=2Fe3++2H2O;为确保除尽铁离子、铜离子杂质而又不损失锰,pH的调整范围为:6.7≤pH<8.3;
故答案为:Cu(OH)2、Fe(OH)3;2Fe2++H2O2+2H+=2Fe3++2H2O;6.7≤pH<8.3;
②滤液2中加入试剂硫酸和氯酸钾,发生反应:3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl,用电解法制备MnO2时,阳极上发生失电子的氧化反应,其电极反应式为:Mn2++2H2O-2e-=MnO2+4H+;故答案为:3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl;Mn2++2H2O-2e-=MnO2+4H+;
(3)根据充电总反应方程式为LiMn2O═4Li1-xMn2O4+xLi,则放电时,当消耗14g即2mol锂时,转移电子是2mol,电池的化学能转化为电能时的能量转化率为85%,所以转移电子是0.85×2mol=1.7mol,故答案为:1.7.
点评 本题考查混合物分离提纯及物质制备实验,为高频考点,把握实验流程中的反应、混合物分离提纯、电解原理为解答 的关键,综合性较强,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 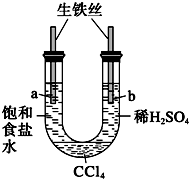 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 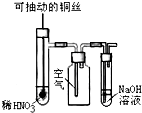 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 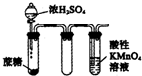 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
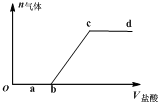 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应溶液中:Ca2+、Mg2+、Br-、NO3- | |
| B. | b点对应溶液中:Al3+、Fe3+、MnO4-、NO3- | |
| C. | c点对应溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲中试剂 | 乙中试剂 | 气体成份及实验目的 | 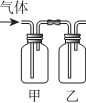 |
| A | NaHSO3溶液 | 硅酸钠溶液 | HCl:证明非金属Cl>S>Si | |
| B | FeI2淀粉溶液 | FeI2、KSCN溶液 | Cl2:验证氧化性Cl2>Fe3+>I2 | |
| C | 溴水 | AgNO3溶液 | 乙烯:验证溴水与乙烯发生的是加成反应 | |
| D | Ba(OH)2溶液 | 品红溶液 | 验证混合气体中含有SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
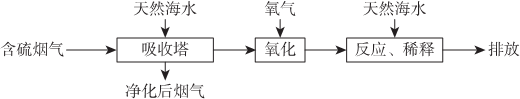
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(甲)>v(乙)>v(丙) | B. | v(乙)>v(丙)>v(甲) | C. | v(丙)>v(乙)>v(甲) | D. | v(乙)>v(甲)>v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
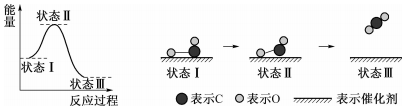
| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO没有断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com