
| A、CaCl2 |
| B、KOH |
| C、H2 |
| D、H2O |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
| A、8 mol |
| B、10 mol |
| C、11 mol |
| D、12 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
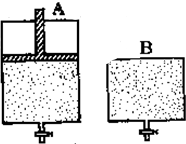 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当△H为“-”时,表示该反应为放热反应 | ||
B、已知C(s)+
| ||
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | ||
| D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2FeCl2→2FeCl3 |
| B、Br2+2Fe2+→2Fe3++2Br- |
| C、2FeCl3+2KI→2FeCl2+2KCl+I2 |
| D、I2+2Fe2+→2I-+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中一定含有离子键 |
| B、含有共价键的化合物一定是共价化合物 |
| C、强电解质与弱电解质的划分标准是电解质在水溶液中导电能力的强弱 |
| D、氧气中氧元素的化合价为0,所以氧分子中没有化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| B、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| C、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- |
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
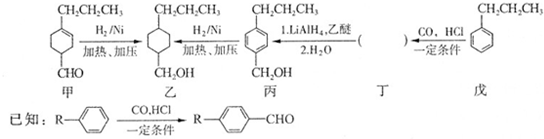
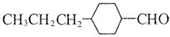 和
和查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com