
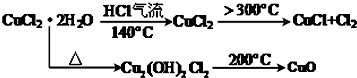
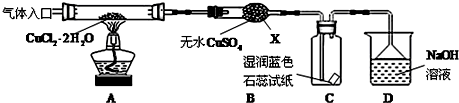
���� �ȷֽ�CuCl2•2H2O�Ʊ�CuCl��Ϊ����ˮ�⣬�������ͨ��HCl���壬Ȼ�����A���Թܣ�XΪ���θ���ܣ�X����ˮ����ͭ��������֪CuCl2•2H2O�ֽ�����ˮ����C����ֽ�ȱ�����ɫ����֪����2CuCl2$\frac{\underline{\;����300��\;}}{\;}$2CuCl+Cl2����D��NaOH��Һ����β����ȡ��CuCl��Ʒ����ʵ�飬�������к���������CuO���ʣ�����CuO��û����HCl�ķ�Χ�м��Ȼ���δ���Թ���ȴ��ֹͣͨ��HCl�����йأ��Դ������
��� �⣺��1����ͼ��������������֪������X������Ϊ���θ���ܣ��ʴ�Ϊ�����θ���ܣ�
��2��ʵ�������������ɣ��ȼ���װ�õ������ԣ����ȷֽ�CuCl2•2H2O�Ʊ�CuCl����ֹCuCl��������Cu+ˮ�����Ա���Ҫ�ȸ���װ���е�������ˮ������ż��ȣ���Ҫ��HCl�����м����Ʊ�����Ӧ��������Ϩ��ƾ��ƣ�Ӧ��Ҫ����ͨ�뵪��ֱ��װ�����У����Բ���˳��Ϊ��a-c-d-b-e��
�ʴ�Ϊ��c-d-b��
��3��B���а�ɫ��Ϊ��ɫ��˵����ˮ���ɣ������л���Cl2������C��ʯ����ֽ����Ϊ��ɫ������ɫ��
�ʴ�Ϊ��ʯ����ֽ����Ϊ��ɫ������ɫ��
��4��D����Cl2��NaOH��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
�ʴ�Ϊ��Cl2+2OH-=Cl-+ClO-+H2O��
��5����2CuCl2$\frac{\underline{\;����300��\;}}{\;}$2CuCl+Cl2��������������ͭ��˵��CuCl�����������Ų�����CuO��˵��װ������������������û����HCl�ķ�Χ�м��Ȼ���δ���Թ���ȴ��ֹͣͨ��HCl���壬�ʴ�Ϊ��ͨ��HCl�������㣮
���� ���⿼�����ʵ��Ʊ�ʵ�飬Ϊ��Ƶ���㣬�����Ʊ�ʵ��ԭ����ʵ��װ�õ����á�Ԫ�ػ�����֪ʶΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�������ʵ�����ϵ�ѵ������5��Ϊ�����ѵ㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
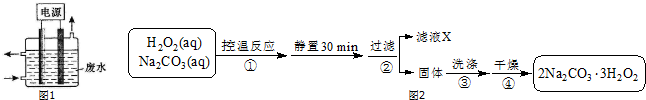
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
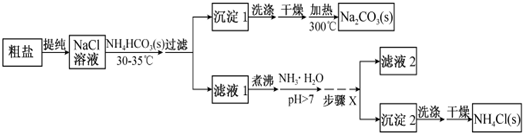
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
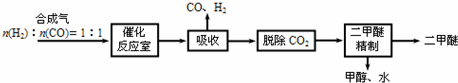
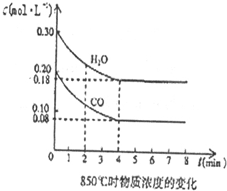
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
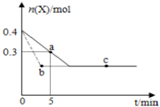 �ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������
�ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������| A�� | ʵ�߱�ʾʹ�ô��������� | |
| B�� | b��c���������Ӧ����Ӧ�����´ﵽ������� | |
| C�� | ��Ӧ�ӿ�ʼ��a���ƽ����Ӧ���ʿɱ�ʾΪv��Y��=0.01mol/��L•min�� | |
| D�� | ��Ӧ���е�a��ʱ�ų����������ڷ�Ӧ���е�b��ʱ�ų������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ǵ����Ϻ����Ϸḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ�������ճ�������������Ҫ���ã�
���ǵ����Ϻ����Ϸḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ�������ճ�������������Ҫ���ã�| t/�� | 25 | 125 | 225 | �� |
| K/��mol•L-1��-2 | 4.1��106 | K1 | K2 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������ڴ�л�����ղ��������� | |
| B�� | ���յ�����û���������� | |
| C�� | ��ʳ�ؽ����λ�ʹ���ж���Ӧ������ţ�̡������ⶾ | |
| D�� | ���Ȼ�ʹ�����ʱ��ԣ�������Լ�������Ժ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com