
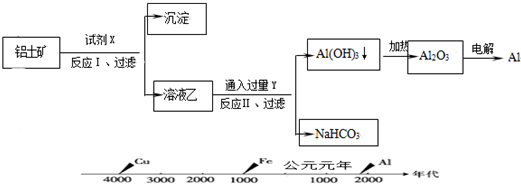
| A、试剂X为稀硫酸 |
| B、反应Ⅱ中生成Al(OH)3的反应为:CO2+2AlO2-+3H2O═2Al(OH)3↓+CO32- |
| C、人类对金属的使用历史与金属活动顺序和冶炼的难易程度有关 |
| D、Al2O3熔点很高,电解耗能大,可采用电解熔融AlCl3冶炼Al |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、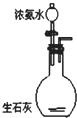 制取氨气 |
B、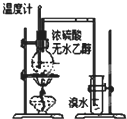 溴水褪色证明了乙烯可以与溴发生加成反应 |
C、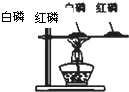 比较红磷和白磷的着火点 |
D、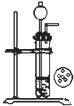 用CaC2和饱和食盐水反应制取C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯 | B、甲酸乙酯 |
| C、乙酸甲酯 | D、丙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3通人AlCl3溶液中 |
| B、用脱脂棉包裹Na2O2粉末露置在潮湿空气中 |
| C、CO2通入CaCl2溶液中 |
| D、稀盐酸滴加到Fe(OH)3胶体溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
| B、将FeS固体投入到含有Cu2+的废水中以除去Cu2+ |
| C、选择合适的催化剂可使水在较低温度下分解 |
| D、滴有酚酞的CH3COONa溶液,加热后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝制品比铁制品在空气中更容易被腐蚀 |
| B、实验室用铜片与稀硝酸反应产生的气体可用排水法收集 |
| C、向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同 |
| D、以海水为原料能制取Na、HCl、Mg、Br2等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有在原子中,质子数才与核外电子数相等 |
| B、O2-半径比F-的小 |
| C、Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 |
| D、P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com