
下列离子方程式正确的是
A.硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-=BaSO4↓
B.AgCl悬浊液中加入硫化钠饱和溶液:2AgCl + S2-=Ag2S +2Cl-
C.硫化钠的水解反应:S2-+H3O+ HS-+H2O
HS-+H2O
D.用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-=37Cl-+3Cl2↑+3H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
常用容量瓶的容积有
①50mL②75ml③l00mL④150mL⑤200mL⑥250mL⑦500mL⑧l000mL
A.①②⑥⑦ B.②④⑦⑧ C.①④⑥⑦ D.③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:填空题
(8分)某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)_____________ 。
A. C7H12O2 B.C6H14 C.C6H14O D. C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为______________。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为_____________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_____________.
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH,盐酸 (填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式 。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈 性(填“酸” 、“中” 或 “碱”),其原因是(用离子方程式表示) 。
(2)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知:CaC2O4沉淀的Ksp=2.3×10-9 ,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1·L-1 ,则生成沉淀所需Na2C2O4溶液的最小起始浓度为
A.2. 3×10-7mol·L-1 B.4. 6×10-7mol·L-1
C.9. 2×10-7mol·L-1 D. ×10-3mol·L-1
×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.加热稀醋酸溶液其pH 稍有减小
C.明矾净水 D.浓的硫化钠溶液有臭鸡蛋气味
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省商丘市高三第三次模拟考试理综化学试卷(解析版) 题型:简答题
(16分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H= -574 kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H= -1160 kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____ 。
II、开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物赢接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)-CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(a)与温度、压强的关系如图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=____ ;
②若A、C两点都表示达到的平衡状态,则白反应开始到达平衡状态所需的时间tA tC(填 “>”、“<”或“=”)。
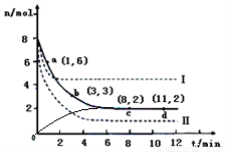
(2)日前工业上也可以用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①若改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变可能是 ,曲线II对应的实验条件改变可能是____ 。
②请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
III、用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。

①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:选择题
分析下表中各项的排布规律,有机物M是按此规律排布的第19项,其中能发生银镜反应又属于 酯类的M的同分异构体(不考虑立体异构)有

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com