
| 1000ρω |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| n |
| V |
| n |
| V |
| n |
| v |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硫酸是化学工业中的重要原料,至2010年我国已成为全球硫酸产能最高、产量最大的国家。
(1)18.4mol/L(质量分数0.98,密度1.84g/cm3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气。当浓硫酸浓度降到16 mol/L(密度1.8g/cm3)以下时,则失去干燥能力。
①16 mol/L的硫酸的质量分数为 (保留两位小数,下同)。
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水 g。
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 9.920 g,与足量稀硫酸反应,收集到气体2.688 L(换算到标准状况),质量为3.440 g。则固体M的成分为
(写化学式),其中铁元素与硫元素的质量比为 。
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20)。
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为 。
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为 %。
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐。为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下:
铵盐质量为10.000 g和20.000 g时,浓硫酸增加的质量相同;
铵盐质量为30.000 g时,浓硫酸质量增重0.680 g;
铵盐质量为40.000 g时,浓硫酸的质量不变。
①计算该混合盐中氮元素的质量分数。
②计算上述氢氧化钠溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2012届上海市闵行区高三上学期期末质量抽测化学试卷 题型:计算题
硫酸是化学工业中的重要原料,至2010年我国已成为全球硫酸产能最高、产量最大的国家。
(1)18.4mol/L(质量分数0.98,密度1.84g/cm3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气。当浓硫酸浓度降到16 mol/L(密度1.8g/cm3)以下时,则失去干燥能力。
①16 mol/L的硫酸的质量分数为 (保留两位小数,下同)。
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水 g。
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 9.920 g,与足量稀硫酸反应,收集到气体2.688 L(换算到标准状况),质量为3.440 g。则固体M的成分为
(写化学式),其中铁元素与硫元素的质量比为 。
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20)。
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为 。
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为 %。
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐。为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下:
铵盐质量为10.000 g和20.000 g时,浓硫酸增加的质量相同;
铵盐质量为30.000 g时,浓硫酸质量增重0.680 g;
铵盐质量为40.000 g时,浓硫酸的质量不变。
①计算该混合盐中氮元素的质量分数。
②计算上述氢氧化钠溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市闵行区高三上学期期末质量抽测化学试卷 题型:计算题
硫酸是化学工业中的重要原料,至2010年我国已成为全球硫酸产能最高、产量最大的国家。
(1)18.4mol/L(质量分数0.98,密度1.84g/cm3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气。当浓硫酸浓度降到16 mol/L(密度1.8g/cm3)以下时,则失去干燥能力。
①16 mol/L的硫酸的质量分数为 (保留两位小数,下同)。
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水 g。
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 9.920 g,与足量稀硫酸反应,收集到气体2.688 L(换算到标准状况),质量为3.440 g。则固体M的成分为
(写化学式),其中铁元素与硫元素的质量比为 。
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20)。
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为 。
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为 %。
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐。为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下:
铵盐质量为10.000 g和20.000 g时,浓硫酸增加的质量相同;
铵盐质量为30.000 g时,浓硫酸质量增重0.680 g;
铵盐质量为40.000 g时,浓硫酸的质量不变。
①计算该混合盐中氮元素的质量分数。
②计算上述氢氧化钠溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
根据下图回答问题:
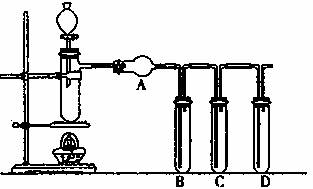
(1)装置气密性的检验须在盛放药品前进行。在上述装置中,往试管B、C、D中各加入5 mL 蒸馏水封住导管口,各连接处都紧密而不漏气的情况下,点燃酒精灯,微热带支管的试管一会儿,试管B、C、D中未出现气泡;熄灭酒精灯后,试管B、C、D中导管内水面也未上升,其原因是: 。
(2)①一般来说,硫酸的质量分数大于60 %,就具有一定的氧化性,且越浓氧化性越强;②温度也要影响氧化性,如铜放于冷的浓硫酸中反应不明显,加热就可观察到明显现象。甲同学利用上述装置,用实验来验证硫酸氧化性的上述结论(已知98%的浓硫酸的密度为1.84g.m-3)。他先向试管B 加人5mL 品红试液,向试管C、D 中各加人5mL饱和澄清石灰水;向带支管的试管中放人铜粉和3mL水,然后从分液漏斗向支管试管中滴加98%的浓硫酸10滴(约0.5mL),加热至沸腾,这时支管试管中溶液颜色是否有明显变化 (填“无”或“有”),试用数据解释其原因 。
该同学用分液漏斗再向支管试管中加98%的浓硫酸10mL,并加热至沸腾,观察到的现象分别是:支管试管中 ,B试管中 。
(3)乙同学利用上述装置来检验浓硫酸和木炭粉在加热条件下发生反应的全部产物
①装置A中应加入的试剂是 。
②装置B、C和D中所加试剂分别是 (填字母序号)
A.澄清石灰水、品红溶液、高锰酸钾酸性溶液
B.品红溶液、高锰酸钾酸性溶液、澄清石灰水
C.高锰酸钾酸性溶液、品红溶液、澄清石灰水
D.澄清石灰水、高锰酸钾酸性溶液、品红溶液
③实验时为了确保D所验证的结论正确,C中应观察到的现象是 。
(4)有同学认为可利用上述装置完成了Cl2的漂白性,氧化性的实验验证,你认为装置A、B、C所加试剂或物品最有可能的分别是 、 、 ;另有同学认为上述装置完成此实验,最好还应加上一个装置,你认为此装置的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com