
分析 用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2.
Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2,与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;
Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
Ⅲ.I和II中的滤液中均为FeCl2,通入足量氯气,反应生成FeCl3,要证明通入氯气足量,则要检验Fe2+的不存在或检验Cl2的存在;
Ⅳ.…,得到FeCl3•6H2O晶体.据此分析,
(1)铜与氯化铁反应生成氯化铁、氯化亚铁;
(2)试剂A只能将铁反应掉,不和铜反应,且不能引入杂质离子;
(3)III中的溶液中为FeCl2,通入足量氯气,要证明通入氯气足量,则要检验Fe2+的不存在或检验Cl2的存在;
(4)由FeCl3溶液得FeCl3•6H2O晶体的方法是加热蒸发、浓缩结晶,然后过滤;
解答 解:用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2.
Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2,与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;
Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
Ⅲ.I和II中的滤液中均为FeCl2,通入足量氯气,反应生成FeCl3;
Ⅳ.…,得到FeCl3•6H2O晶体.
(1)铜与氯化铁反应生成氯化铁、氯化亚铁,化学反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故答案为:2Fe3++Cu═2Fe2++Cu2+;
(2)根据上面的分析可知,A为盐酸,故答案为:盐酸;
(3)III中要证明通入氯气足量,则要检验Fe2+的不存在或检验Cl2的存在,故选ac;
(4)由FeCl3溶液得FeCl3•6H2O晶体的方法是加热蒸发、浓缩结晶,然后过滤,故选ab,
故答案为:ab.
点评 本题考查了物质分离提纯的实验过程分析,主要是离子性质、离子反应、溶液配制等知识点的理解应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 甲的球棍模型 | 乙的结构式 | 丙的球棍模型 | 丁的比例模型 |
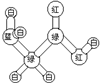 | 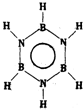 | 丙的分子式为C13H10O3 | 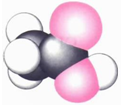 |
| A. | 甲可代表氨基酸 | B. | 乙的二氯代物有3种 | ||
| C. | 丙的结构简式为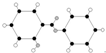 | D. | 丁可代表乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
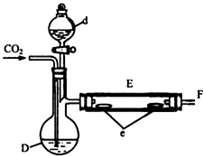 实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答:
实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答:| 实验操作 | 实验现象 | 氧化性强弱 |
| ① | 溶液呈血红色 | ② |
| ③ | ④ | Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力发展以煤炭为原料的火力发电,促进经济发展 | |
| B. | 在生产和生活中提倡使用节能技术和节能用具 | |
| C. | 开发新能源,代替传统能源 | |
| D. | 提倡乘坐公交车、骑自行车或步行的方式出行 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 金属 离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-142.9 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 2H2+O2=2H2O;△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1中正极电极反应式为:O2+4e-+4H+=2H2O | |
| B. | 图2表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| C. | 图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示向NH4 Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,生成沉淀总物质的量(n)随着Ba(OH)2溶液体积(y)的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com