
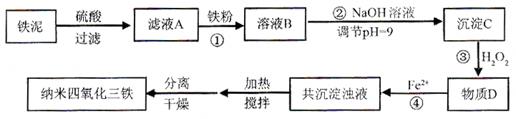
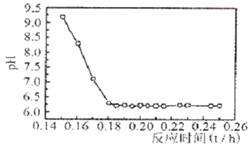
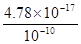 4.87×10-7mol·L—1,此时已经完全沉淀。
4.87×10-7mol·L—1,此时已经完全沉淀。 =3.36吨,其中相当于氧化铁的质量是2.24吨,另外的铁来自于亚铁离子。10吨铁泥中铁的质量是16.8 %×10=1.68吨,所以需要铁粉的质量是2.24吨-1.68吨=0.56吨。
=3.36吨,其中相当于氧化铁的质量是2.24吨,另外的铁来自于亚铁离子。10吨铁泥中铁的质量是16.8 %×10=1.68吨,所以需要铁粉的质量是2.24吨-1.68吨=0.56吨。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.只有Fe2+和Cu2+ | B.一定有Fe2+、Cu2+,可能有Fe3+ |
| C.一定有Fe2+,可能有Cu2+ | D.只有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用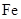 ,
, (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.
白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.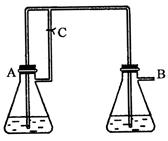
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(m+4.8)g | B.(m+5.1)g | C.(m+10.2)g | D.(m+19.2)g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mL bmol·L
mL bmol·L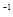 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )| A.若金属有剩余,在溶液中再滴入硫酸后,剩余金属一定又开始溶解 |
B.若金属全部溶解,则溶液中一定含有Fe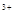 |
C.若金属全部溶解,且产生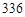 mL气体(标准状况),则b mL气体(标准状况),则b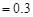 |
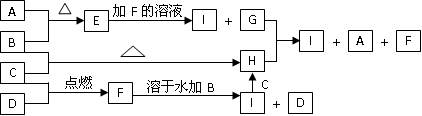
D.当溶液中金属离子只有Fe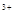 、Cu 、Cu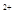 时,则a与b的关系为:b≥ 时,则a与b的关系为:b≥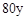 (1 (1 a/3) a/3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3O4既可看做是氧化物,又可看做是亚铁盐 |
| B.反应②配平后,H2O的化学计量数为3 |
| C.反应③是非氧化还原反应 |
| D.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
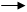 (4)写出G+H I+A+F的离子方程式_______________________________。
(4)写出G+H I+A+F的离子方程式_______________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com