
【题目】某铜铁合金中铜和铁的物质的量之和为ymol,其中铜的物质的量分数为a,将其全部投入50mLbmol/L的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A. 当溶液中金属离子只有铁离子和铜离子时,则a和b的关系为b≥80y(1-a/3)
B. 若金属有剩余,在溶液中再滴入硫酸后,金属不会溶解
C. 若金属全部溶解,则溶液中一定含有铁离子
D. 若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
【答案】A
【解析】
A.反应中失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,得失电子数目相同;B.溶液中有硝酸根离子时,再加入硫酸,溶液具有强氧化性,金属能溶解;C.金属全部溶解,铁元素在溶液中可能以Fe2+形式存在;D.若金属全部溶解,失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,反应中硝酸起氧化剂、酸性作用,根据氮元素守恒计算起氧化剂作用的硝酸的量。
A.根据铁和铜与硝酸的反应,体现酸性的硝酸生成了Fe(NO3)3和Cu(NO3)2,为3y(1a)mol+2yamol=(3yya)mol,作氧化剂的硝酸得到的电子数目等于Fe、Cu失去的电子数目,由于NO是唯一的还原产物,所以作氧化剂的硝酸为![]() mol,所以硝酸的总物质的量为(3yya)mol +
mol,所以硝酸的总物质的量为(3yya)mol +![]() mol=
mol=![]() mol,硝酸的物质的量浓度为c(HNO3)=
mol,硝酸的物质的量浓度为c(HNO3)=![]() =80y(1-
=80y(1-![]() )mol/L,因为硝酸还可能有剩余,所以b≥80y(1a/3),故A正确;
)mol/L,因为硝酸还可能有剩余,所以b≥80y(1a/3),故A正确;
B.若金属有剩余,因溶液中有硝酸根离子,在溶液中再滴入硫酸后,氢离子和硝酸根离子可继续氧化剩余的金属,故B错误;
C.当铁的量较多时,可以将生成的铁离子再还原为亚铁离子,溶液中不一定含有Fe3+,故C错误;
D.硝酸中氮元素的化合价由+5价降低到+2价,当产生336mL(标准状况)即0.015mol一氧化氮时,转移电子的物质的量为0.015mol×(52)=0.045mol,作氧化剂的硝酸为0.015mol,所以作氧化剂的硝酸的物质的量浓度为0.015mol÷0.05L=0.3mol/L,因还有一部分硝酸体现了酸性,所以硝酸的物质的量浓度大于0.3mol/L,即b>0.3,故D错误,答案选A。


科目:高中化学 来源: 题型:
【题目】实验室制硝基苯的主要步骤如下:
① 在250mL的圆底烧瓶中放入17.7 mL苯,配上一个双孔橡皮塞,一个孔插入一支100℃温度计,其水银球要进入液面下,另一个孔插入长颈漏斗,仪器装置如图所示。

②通过长颈漏斗上口将已配制好的混酸分多次加入烧瓶中。每加一次,必须振荡烧瓶,当反应物温度不再上升而趋下降时,才可继续加混酸。反应温度应保持在40—50℃,若超过50℃,可用冷水浴冷却烧瓶,加料完毕后,把烧瓶放在水浴上加热,约10分钟内把水浴加热到55-60℃,并保持30分钟,间歇地振荡烧瓶。
③冷却后将反应物倒入分液漏斗,静置分层,分出酸液和粗硝基苯,由于工业浓H2SO4中含有少量汞盐等杂质有催化作用,使反应产物中含有苦味酸(2,4,6-三硝基苯酚)和2,4-二硝基苯酚使粗硝基苯呈浅黄色,此外还含有间二硝基苯。已知:苦味酸与2,4-二硝基苯酚均有酸性,能与碱反应;间二硝基苯性质与硝基苯类似。请回答下列问题
(1)步骤①中长颈漏斗的作用
a _______________________,b _______________。
(2)步骤 ②中,每加入一次混酸,必须振荡烧瓶的目的_____________________。
(3)步骤②中,需严格控制温度的原因___________________________________。
(4)步骤③中,静置分层后,粗硝基苯在分液漏斗_____ 层。
(5)要将粗硝基苯中混有少量酸液、苦味酸、2,4一二硝基苯酚以及二硝基苯,除去得到纯净的硝基苯必须进行的五步操作名称为a __________ 、 b _____________、c _________ 、 d _____________、e_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为LiCoO2 +6C![]() li1-xCoO2 +lixC6,结构如图所示。下列说法正确的是
li1-xCoO2 +lixC6,结构如图所示。下列说法正确的是
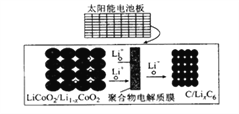
A. 放电时,正极质量增加
B. 充电时,锂离子由右向左移动
C. 该钾离了电池工作时,涉及到的能量形式有3 种
D. 充电时、阳极的电极反应式为Li1-xCoO2+xLi++xe-= LiCoO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。则Na2O2与SO2反应的化学方程式为( )
A.SO2+Na2O2=Na2SO4B.2SO2+2Na2O2=2Na2SO3+O2
C.SO2+Na2O2=Na2SO3D.SO2+Na2O2=Na2SO4 +O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物和足量的银氨溶液在微热条件下发生银镜反应,生成10.8 g银,而燃烧等量的有机物时,需消耗氧气6.16 L(标准状况),该有机物是( )
A. 葡萄糖 B. 甲酸乙酯 C. 丁醛 D. 乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是 ( )
A. 二氧化硅与强碱溶液反应:SiO2+2OH-=SiO32-+H2O
B. 氯水与SO2溶液反应:Cl2+SO2+2H2O=4H++ClO-+SO32-
C. 二氧化锰与浓盐酸反应:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D. 将二氧化氮气体通入水中:3NO2+H2O=2H++2NO3-+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铜和含有2.4×10-3mol 硝酸的某浓硝酸完全反应,共收集到标准状况下气体的体积是22.4 mL。参加反应的铜的物质的量是( )
A. 0.6×10-3 molB. 0.7×10-3 mol
C. 0.75×10-3 molD. 0.9×10-3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为
A. ![]() B.
B. ![]()
C. ![]() D. 1 000VρM(MV+2 240)
D. 1 000VρM(MV+2 240)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
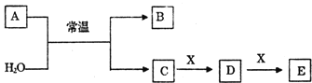
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式________________________________________。
(2)若A为电石(CaC2),X为深红棕色液体非金属单质,写出D + X → E反应的化学方程式为________________________________ 。
(3)若A为淡黄色粉末,回答下列问题:
①A与H2O反应的离子方程式为__________________________________ 。
②若X为非金属单质,通常为黑色粉末,写出D的结构式为______________。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为_________。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X为常见的金属单质,在溶液D中滴加KSCN溶液会变红色。
①A与H2O反应的化学反应方程式为__________________________________ 。
②指明X 在元素周期表中位置为________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com