
【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O5
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的叙述中正确的是( )
A. 溶液呈中性的盐一定是强酸、强碱生成的盐
B. 含有弱酸根盐的水溶液一定呈碱性
C. 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D. 强酸强碱盐的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,其中正确的是( )
(1)碱 (2)含氧酸盐 (3)钠盐 (4)碳酸盐
A. (2)(3)(4) B. (1)(3)(4) C. (1)(2)(4) D. (1)(2)(3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol/LA1C13 溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A. 甲中沉淀一定比乙中多 B. 乙中沉淀可能比甲中的多
C. 甲中沉淀一定比乙中的少 D. 甲中和乙中的沉淀可能一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题: 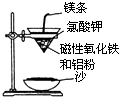
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色.
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是 .
②若要证明反应所得“铁块”中含有金属铝,可用(填化学式)溶液,所发生反应的离子方程式为 .
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H++4I﹣+O2=2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8molL﹣1 KI溶液、0.1molL﹣1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A﹣C三组实验,部分实验数据如下表:
编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 | 出现蓝色时间/s |
A | 39 | 10 | 5 | 5 | 1 | 5 |
B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
C | 5 | 10 | 5 | 5 | 1 | 39 |
D | t |
①为确保A组实验在39℃下进行,应采用的控温操作方法是 .
②A﹣C三组实验时,都加入了5mL水,其目的是 .
③B组实验中“没出现蓝色”,原因是 .
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(3)⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。

(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△>0)某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置中SO2的吸收效率,B中试剂是________,表明SO2吸收效率低的实验现象是B中溶液________________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是_______、_______。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=12), 限用试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管、
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取ag KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液溶液的体积为vmL 则c(Na2S2O3溶液)=_______mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O ,2S2O32-+I2=S4O62-+2I- 某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能_____(填“不受影响”、“偏低”或“偏高”) ,原因是________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入4 mol A,在一定温度和体积可变的密闭容器中发生如下反应:4A(g) ![]() 3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
A. 若向密闭体系内再加入3molB、2molC,达平衡时C的百分含量与原平衡相同
B. 达到平衡时气体的总物质的量、密度都不发生变化
C. 反应达平衡的过程中,释放出的热量不发生变化
D. 升高温度A的转化率大于30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42—的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为
A. 5.6 g B. 11.2 g C. 22.4 g D. 33.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com