
【题目】下列关于物质结构的说法不正确的是
A.在NH3和PH3分子中键长:N-H>P-H
B.晶格能:NaF>NaCl>NaBr
C.CS2的填充模型:![]()
D.CH4和NH4+都是正四面体结构,键角均为109°28′
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)0.005mol/L的H2SO4溶液的pH为_______。
(2)常温时,0.1mol/L的NaOH和0.06mol/L的H2SO4溶液等体积混合,求混合溶液的pH为_______。
(3)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________,该温度________(填“高于”或“低于”)25 ℃。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。若所得混合溶液呈中性,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | -97 | -12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。
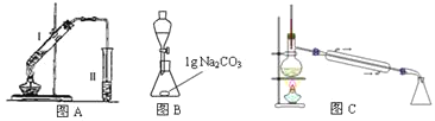
(1)苯甲酸与甲醇反应的化学方程式为_____________________________________________。
(2)大试管Ⅰ中除了装有15g苯甲酸和一定量的甲醇和一定量浓硫酸外还需要加入沸石,其作用是_______________________。
(3)中学实验室中制取乙酸乙酯时为了提高产率可以采取的措施有:(答两条措施)_______________。
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(4)用图B装置进行水洗提纯时,为了洗去苯甲酸甲酯中过量的酸,B装置中应加入______________。
(5)用图C装置进行蒸馏提纯时,当温度计显示_________℃时,可用锥形瓶收集苯甲酸甲酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,恒温条件下,向某一体积为2L的密闭容器中充入2molN2和6molH2,经10s达到平衡,平衡后压强为初始压强的
2NH3(g) △H<0,恒温条件下,向某一体积为2L的密闭容器中充入2molN2和6molH2,经10s达到平衡,平衡后压强为初始压强的![]() 。则下列说法正确的( )
。则下列说法正确的( )
A.要提高N2转化率同时加快反应速率,可采取的措施有缩小体积、充入N2、降低温度
B.若该反应的平衡常数发生变化,平衡不一定移动
C.保持温度和容器体积不变,再向容器中充入1molN2和2molNH3,此时v正=v逆
D.10s内,v(NH3)=0.1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.次氯酸钠溶液中通入少量的二氧化硫:SO2+3ClOˉ+H2O=SO42ˉ+Clˉ+2HClO
B.碳酸氢钠溶液与足量盐酸反应:CO32ˉ+2H+=CO2↑+H2O
C.稀硫酸和氢氧化钡溶液反应:Ba2++OHˉ+H++SO42ˉ= BaSO4↓+H2O
D.锌和浓硫酸反应:Zn+2H+=H2↑+Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯化合物在工业上有着广泛的用途。
Ⅰ.高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室可用NaClO4与NH4Cl制取。
(部分物质溶解度如图1、图2),流程如图3:
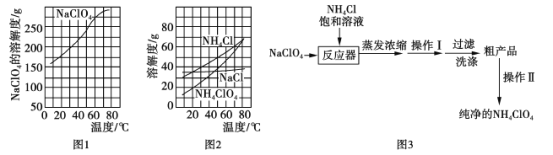
(1)反应器中发生反应的化学方程式为_______。
(2)上述流程中操作Ⅰ为__________,操作Ⅱ为__________。
(3)上述流程中采取的最佳过滤方式应为__________(填字母代号)
A.升温至80℃以上趁热过滤
B.降温至0℃左右趁冷过滤
C.0℃-80℃间任一温度过滤
Ⅱ.一氯化碘(沸点97.4℃)是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某学习小组拟用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
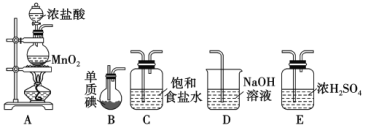
(1)各装置连接顺序为A→___________→___________→___________→___________
(2)B装置烧瓶需放在冷水中,其目的是___________,D装置的作用是________________。
(3)将B装置得到的液态产物进一步提纯可得到较纯净的ICl,则提纯采取的操作名称是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是

A. 水电离出的c(H+):A点小于B点
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)=12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用,某化学兴趣小组利用图一装置探究氨气的有关性质。
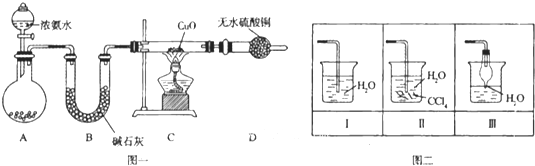
(1)装置A中烧瓶内试剂可选用 (填序号)。B的作用是
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,.该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com