
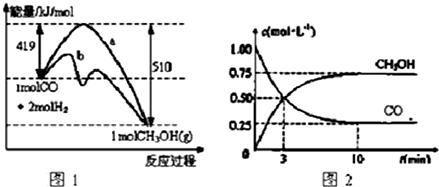
分析 (1)催化剂只影响反应速率不化学平衡移动,且反应过程中焓变不变;
(2)A.该反应是体积减小的反应,当压强不变时,说明各组分浓度不再变化;
B.根据图知,起始充入容器的n(CO)=cV=1.00mol/L×2L;
C.增加CO浓度,平衡正向移动,但CO的转化率降低;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动;
(3)前10min,CO的速率=$\frac{1.00-0.25}{10}$mol/(L.min);若容器体积不变,加入He,参加反应的各物质的物质的量浓度不变,则平衡不移动,各物质的反应速率不变;
(4)升高温度,平衡向吸热反应方向移动;
(5)学家常用量热计(填仪器名称)来直接测定某一反应的反应热;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-385.8kJ/mol ①,
H2O(l)=H2O(g)△H=+44kJ/mol②,
将方程式$\frac{1}{2}$①-2②得甲醇燃烧热化学方程式.
解答 解:(1)催化剂只影响反应速率不化学平衡移动,且反应过程中焓变不变,根据图知,改变条件时,活化能降低而焓变不变,说明改变的条件是使用了催化剂,
故答案为:使用了催化剂;
(2)A.该反应是体积减小的反应,当压强不变时,说明各组分浓度不再变化,反应达到平衡状态,故A正确;
B.根据图知,起始充入容器的n(CO)=cV=1.00mol/L×2L=2mol,故B正确;
C.增加CO浓度,平衡正向移动,但CO的转化率降低,故C错误;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,再次达到平衡时n(CH3OH)/n(CO)会增大,故D正确;
故选C;
(3)前10min,CO的速率=$\frac{1.00-0.25}{10}$mol/(L.min)=0.075mol/(L.min);若容器体积不变,加入He,参加反应的各物质的物质的量浓度不变,则平衡不移动,各物质的反应速率不变,
故答案为:0.075mol/(L.min);不变;
(4)升高温度,平衡向吸热反应方向移动,根据图1知,该反应的正反应是放热反应,升高温度平衡逆向移动,即向左移动,故答案为:左;
(5)学家常用量热计(填仪器名称)来直接测定某一反应的反应热;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-385.8kJ/mol ①,
H2O(l)=H2O(g)△H=+44kJ/mol②,
将方程式$\frac{1}{2}$①-2②得甲醇燃烧热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol.
点评 本题考查盖斯定律、平衡移动方向判断、反应速率计算等知识点,侧重考查学生分析计算能力,为高频考点,注意:增加可逆反应中某一反应物浓度,平衡正向移动但该物质的转化率反而降低,为易错点.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气是一种有强烈刺激气味的气体 | |
| B. | 氨气能被氧化为NO,是工业生产硝酸的重要原料之一 | |
| C. | 铵盐易和碱反应生成具有挥发性的氨气,在实验室中用NH4Cl和Ca(OH)2的混合物制取氨气 | |
| D. | 氨气极易溶于水,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团:
(1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团: 和
和 (填化学式),所以这个化合物看作羧酸类和醛类.
(填化学式),所以这个化合物看作羧酸类和醛类. ,此烃的名称为3-甲基-2-乙基-1-戊烯
,此烃的名称为3-甲基-2-乙基-1-戊烯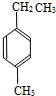 ,此烃名称为对甲基乙苯或4-甲基乙基苯
,此烃名称为对甲基乙苯或4-甲基乙基苯 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 | |
| B. | 一种物质被氧化,必然有另一种物质被还原 | |
| C. | 被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 | |
| D. | 氧化剂在反应中被氧化,还原剂在反应中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有常温下的0.1mol/L小苏打溶液,回答下列问题:
现有常温下的0.1mol/L小苏打溶液,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com