
下列事实能用勒夏特列原理来解释的是( )
A.SO2氧化SO3,往往需要使用催化剂2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
B.500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g) 2NH3(g) △H<0
2NH3(g) △H<0
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g) 2HI(g)
2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
科目:高中化学 来源:2015-2016学年四川省华蓥市高一下期末化学试卷(解析版) 题型:选择题
下列关于元素周期表的说法不正确的是( )
A. 元素周期表中一共有16个纵行
B. 除0族元素外,非金属元素全是主族元素
C. 同周期第IIA族与第IIIA元素的原子序数之差可能为25
D. 同主族上下相邻的两种元素的原子序数之差可能为32
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:选择题
向盛有硫酸铜水溶液的试管里滴入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液。若加入乙醇将析出深蓝色晶体。下列说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤对电子
C.沉淀溶解后将生成深蓝色的正四面体形的配离子[Cu(NH3)4]2+
D.加入极性较小的溶剂乙醇后,将析出[Cu(H2O)4]SO4•H2O晶体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一下期末化学试卷(解析版) 题型:选择题
尿酸是人体的一种代谢产物,关节炎形成的原因就是在关节的滑液中形成尿酸钠(通常用NaUr表示)晶体:HUr Ur-+H+ ① Ur-+Na
Ur-+H+ ① Ur-+Na NaUr ②
NaUr ②
第一次关节炎发作的时间大都在寒冷季节,发病部位常常是手指的关节处,下列推侧正确的是
A.反应②是吸热反应
B.热敷可以关节炎的症状减轻有一定的道理
C.NaUr易溶于水
D.关节炎发病时关节滑液的酸性减弱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一下期末化学试卷(解析版) 题型:选择题
下列物质既能导电又属电解质的是
A.硝酸钾溶液 B.硫酸铜晶体 C.熔融的氯化钠 D.无水乙醇
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一下期末化学试卷(解析版) 题型:选择题
为了保护环境.下列做法不可取的是( )
①开发新能源,减少矿物燃料的燃烧
②关闭所有的化工企业
③提倡使用一次性发泡塑料餐具和塑料袋
④开发、生产无汞电池
⑤机动车安装尾气净化器
A.①②③ B.③④⑤ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省等三校高一下期末化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含单键数目为0.7NA
C.标准状况下.5.6 LCO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL1 2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二下期末化学试卷(解析版) 题型:实验题
(10分)物质G可用来制备抗凝血药,通过下列路线可合成G。

(1)F的分子式为__________,E的结构简式为__________,G中所含官能团的名称为__________;
(2)C+E→F的反应类型为__________;1molF最多能消耗________molNaOH。
(3)请写出满足下列条件的D的同分异构体(不考虑立体异构)的结构简式__________。
①能与氯化铁溶液发生显色反应 ②苯环上有两个取代基,且苯环上的一氯代物只有2种
③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南曲靖一中高一下期末化学试卷(解析版) 题型:填空题
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况下),实验记录如下(累计值):
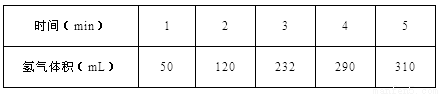
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大_______。
②2~3分钟时间段以盐酸的浓度变化来表示的该反应速率______。(设溶液体积不变)
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液,你认为可行的是___________。
(2)将等物质的量A、B混合于2L密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,此时A的浓度与B的浓度之比为3:5,C的平均反应速率是0.1mol/(L·min) 则平衡时A的浓度为__________mol/L,B的平均反应速率 ______mol/(L·min)。
xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,此时A的浓度与B的浓度之比为3:5,C的平均反应速率是0.1mol/(L·min) 则平衡时A的浓度为__________mol/L,B的平均反应速率 ______mol/(L·min)。
(3)已知断裂1molC-H,O=O,C=O,H-O化学键所需能量分别为akJ,bkJ,ckJ,dkJ,则该反应CH4+O2=CO2+2H2O的反应热为△H=________kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com