
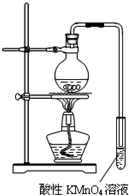
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.分析 (1)溴乙烷在强碱的醇溶液中发生消去反应生成乙烯;
(2)从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,所以使酸性KMnO4溶液颜色褪去不一定是产生的乙烯在作用;
(3)根据(1)的分析,只要在通入酸性KMnO4溶液之前除去乙醇就可以证明乙烯的生成了;
(4)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%不难分析原因;
(5)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管.
解答 解:(1)溴乙烷在强碱的醇溶液中发生消去反应生成乙烯,反应的化学方程式为:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,
故答案为:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O;
(2)因为乙醇具有挥发性,所以从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,乙烯和乙醇都可以使酸性KMnO4溶液颜色褪去,故不一定是产生的乙烯,
故答案为:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色;
(3)根据(1)的分析,只要在通入酸性KMnO4溶液之前除去乙醇就可以证明乙烯的生成了,除去乙醇最简单的方法就是通入水中而且又不影响乙烯,故答案为:在小试管之前增加一个盛有冷水的洗气瓶;
(4)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%,所以应该是反应温度较低主要发生了取代反应,方程式为:CH3CH2Br+NaOH $\stackrel{55℃}{→}$CH3CH2OH+NaBr,
故答案为:反应温度较低;CH3CH2Br+NaOH $\stackrel{55℃}{→}$CH3CH2OH+NaBr;
(5)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管,
故答案为:冷凝管;量程为200℃温度计.
点评 本题考查了探究物质的组成实验方案设计,侧重于探究溴乙烷的消去反应的条件并验证产物,培养学生提取信息的能力,并利用好这些信息来设计好实验,题目难度中等.


科目:高中化学 来源: 题型:选择题
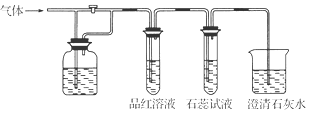
| A. | H2S和浓H2SO4 | B. | SO2和NaHCO3溶液 | C. | Cl2和NaHCO3溶液 | D. | Cl2和氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
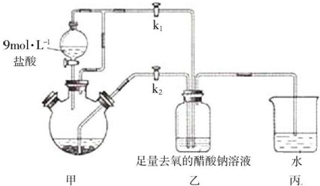
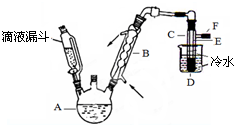 图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.
图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| 水溶性 | 易溶 | 难溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
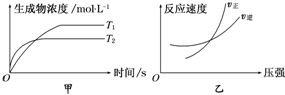
| A. | a+b>c+d T1>T2△H>0 | B. | a+b>c+d T1<T2 △H<0 | ||
| C. | a+b<c+d T1>T2△H>0 | D. | a+b>c+d T1>T2△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都加大,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都没有变化,平衡不发生移动 | |
| C. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水可使pH试纸先变红,后褪色 | |
| B. | 氯水放置数天后,溶液的酸性逐渐减弱 | |
| C. | 新制的氯水只含Cl2和H2O分子 | |
| D. | 光照氯水有气泡逸出,该气体是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与28 gCO具有相同分子数的C2H4的质量一定是28 g | |
| B. | 1 molAl 3+含有的核外电子数为3NA | |
| C. | 常温常压下,1 mol甲烷含有的原子数为5NA | |
| D. | 常温常压下,1 molL氢气的体积大于22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com