
 煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)?CH3OH(g)
煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)?CH3OH(g) | 时间/浓度 | c(CO)(mol/L) | c(H2)(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4min | a | b | c |
| m |
| n |
| m |
| n |
| 3 |
| 5 |


科目:高中化学 来源: 题型:
| 选项 | 酸性强弱 | 中和后溶液PH值 |
| A | HA>HB | 乙>甲 |
| B | HA>HB | 乙<甲 |
| C | HA<HB | 乙>甲 |
| D | HA<HB | 乙<甲 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室进行工业合成氨的模拟实验:
在实验室进行工业合成氨的模拟实验:查看答案和解析>>
科目:高中化学 来源: 题型:
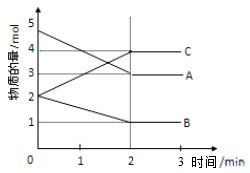 某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973k | 1173k | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | k1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | k2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | k3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
 丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )
丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )| A、丹参素的分子式为C9H10O5 |
| B、丹参素能发生缩聚、消去、氧化反应 |
| C、1 mol丹参素最多可以和3mol H2发生加成反应 |
| D、1 mol丹参素与足量Na2CO3发生反应最多可生成二氧化碳1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C60是一种新型的化合物 |
| B、C60含有离子键 |
| C、C60的摩尔质量为720 |
| D、C60中的化学键只有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com