
【题目】已知:A、B、C、D、E、F六种元素核电荷数依次增大,属元素周期表中前四周期的元素。其中A原子核外有三个未成对电子;B和E可形成离子化合物B2E,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
⑴A、B、C、D的第一电离能由小到大的顺序为________(用元素符号表示)。
⑵E与D的同族短周期元素可形成一种化合物X,X是常见的有机溶剂,X分子的空间构型是________。
⑶F原子的核外电子排布式是____________,F的高价离子与A的简单氢化物形成的配离子的化学式为________。
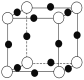
⑷A、F形成某种化合物的晶胞结构如图所示,则其化学式为________(黑色球表示F原子)。
⑸A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为________。
【答案】Na<Al<Si<N 直线形 1s22s22p63s23p63d104s1 [Cu(NH3)4]2+ Cu3N 共价键
【解析】
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属元素周期表中前四周期的元素。其中A原子核外有三个未成对电子,则A为N,E原子核外的M层中只有两对成对电子,则E为S,B和E可形成离子化合物B2E,则B为Na,C元素是地壳中含量最高的金属元素,则C为Al,D单质的熔点在同周期元素形成的单质中是最高的,则D为Si,F原子核外最外层电子数与B相同即最外层只有1个,其余各层均充满,则F为Cu。
⑴同周期从左到右第一电离能具有增大的趋势,同主族从上到下第一电离能逐渐减小,因此A、B、C、D的第一电离能由小到大的顺序为Na<Al<Si<N;故答案为:Na<Al<Si<N。
⑵E与D的同族短周期元素即C可形成一种化合物X(CS2),X是常见的有机溶剂,CS2分子中C价层电子对数![]() ,其空间构型是直线形;故答案为:直线形。
,其空间构型是直线形;故答案为:直线形。
⑶F是Cu,29号元素,Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,F的高价离子即Cu2+与A的简单氢化物即NH3形成的配离子的化学式为[Cu(NH3)4]2+;故答案为:1s22s22p63s23p63d104s1;[Cu(NH3)4]2+。
⑷N、Cu形成某种化合物的晶胞结构如图所示,N的个数为![]() ,Cu的个数为
,Cu的个数为![]() ,则其化学式为Cu3N;故答案为:Cu3N。
,则其化学式为Cu3N;故答案为:Cu3N。
⑸A、C形成的化合物(AlN)具有高沸点和高硬度,说明是原子晶体,其晶体中所含的化学键类型为共价键;故答案为:共价键。


科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一。![]() 丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是![]()
![]()

A.氢化物的沸点:![]()
B.元素的非金属性:![]()
C.化合物![]() 和XYZ中均只含极性键
和XYZ中均只含极性键
D.丙也可由W、Y组成的某种化合物与K直接反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A.Q1=2Q2=92.4B.Ql>2Q2C.Q1<2Q2D.Q1=2Q2≠92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有容积为1 L的甲乙两个恒温恒容密闭容器,向甲中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g)![]() C(g) △H= -a kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是( )
C(g) △H= -a kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是( )
A.Q1 + Q2= aB.Q1 + 2Q2< 2aC.Q1 + 2Q2> 2aD.Q1 + Q2< a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①则反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
②根据表中数据,可推知该反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
(3)在容积为VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。

①p1__(填“大于”“小于”或“等于”)p2。
②在其他条件不变的情况下,再增加amolCO与2amolH2,达到新平衡时,CO的转化率__(填“增大”“减小”或“不变”,下同),平衡常数__。
查看答案和解析>>
科目:高中化学 来源: 题型:
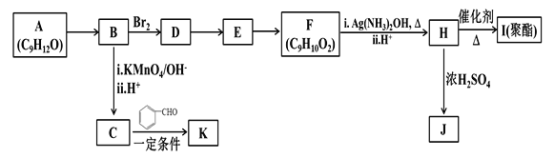
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②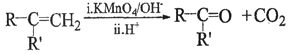
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiC有两种晶态变体:α—SiC和β—SiC。其中β—SiC为立方晶胞,结构与金刚石相似,晶胞参数为434pm。针对β—SiC回答下列问题:
⑴C的配位数为__________。
⑵C和Si的最短距离为___________pm。
⑶假设C的原子半径为r,列式并计算金刚石晶体中原子的空间利用率_______。(![]()
![]() π =3.14)
π =3.14)
查看答案和解析>>
科目:高中化学 来源: 题型:
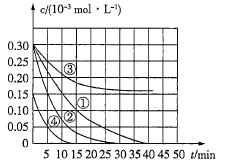
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究其降解效果,设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度变化与时间的关系如图所示,下列说法不正确的是( )
实验编号 | 温度(K) | pH |
① | 298 | 1 |
② | 310 | 1 |
③ | 298 | 7 |
④ | 298 | 2 |
A.实验①在15min内M的降解速率为1.33×10-5mol·L-1·min-1
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.若其他条件相同,实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,“低碳经济”备受关注,![]() 的产生及有效开发利用成为科学家研究的重要课题.
的产生及有效开发利用成为科学家研究的重要课题.
![]() 向浓
向浓![]() 溶液中通入
溶液中通入![]() 和
和![]() ,可以制得纳米级碳酸钙
,可以制得纳米级碳酸钙![]() 粒子直径在
粒子直径在![]() 之间
之间![]() ①向浓
①向浓![]() 溶液中通人
溶液中通人![]() 和
和![]() 气体制纳米级碳酸钙时,应先通入
气体制纳米级碳酸钙时,应先通入![]() ,后通入
,后通入![]() 制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
![]() 定条件下,
定条件下,![]() 和
和![]() 反应,能生成
反应,能生成![]() 和
和![]() 将
将![]() 和
和![]() 分别加入甲、乙两个密闭容器中,发生反应:
分别加入甲、乙两个密闭容器中,发生反应:![]() ,其相关数据如下表所示:
,其相关数据如下表所示:
容器 | 容积 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | |
|
|
| ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______
______
②乙容器中,当反应进行到![]() 时,
时,![]() 的物质的量浓度 ______
的物质的量浓度 ______ ![]() 填选项字母
填选项字母![]() .
.
A.![]()
![]()
![]()
![]()
③丙容器的容积为1L,![]() 时,起始充入amol
时,起始充入amol![]() 和bmol
和bmol![]() ,反应达到平衡时,测得
,反应达到平衡时,测得![]() 的转化率大于
的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______ ;
的值需满足的条件为 ______ ;
④丁容器的容积为1L,![]() 时,按下列配比充入
时,按下列配比充入![]() 、
、![]() 、
、![]() 和
和![]() ,达到平衡时各气体的体积分数与甲容器完全相同的是 ______
,达到平衡时各气体的体积分数与甲容器完全相同的是 ______ ![]() 填选项字母
填选项字母![]() .
.
A.![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() 、
、![]() 、O
、O
C.![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 、
、![]() 、
、![]() 、
、![]()
![]() 在一定条件下可转化为甲醚
在一定条件下可转化为甲醚![]() 用甲醚燃料电池做电源,用惰性电极电解饱和
用甲醚燃料电池做电源,用惰性电极电解饱和![]() 溶液可制取
溶液可制取![]() 和KOH,实验装置如图所示
和KOH,实验装置如图所示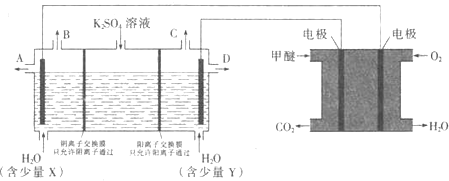
①甲醚燃料电池的负极反应式为 ______
②![]() 口导出的物质为 ______
口导出的物质为 ______ ![]() 填化学式
填化学式![]() .
.
③若燃料电池通入![]() 的速率为
的速率为![]() ,2min时,理论上C口收集到标准状况下气体的体积为 ______ .
,2min时,理论上C口收集到标准状况下气体的体积为 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com