
分析 (1)银离子与硫酸根生成硫酸银沉淀从而不能共存,硫酸铁为电解质溶液与氢氧化铁胶体形成聚沉;
(2)Fe2(SO4)3溶液和Ba(OH)2溶液反应生成硫酸钡和氢氧化铁;
(3)V1L Fe2(SO4)3溶液中,含有Fe3+ ag,则n(Fe3+)=$\frac{ag}{56g/mol}$=$\frac{a}{56}$,根据化学式可得SO42-的物质的量为n(SO42-)=$\frac{3}{2}$×n(Fe3+)=$\frac{3}{2}$,c(SO42-)=$\frac{3amol}{112×1L}$=$\frac{3a}{112}$mol/L,取出0.25L该溶液,体积减小,浓度不变,所以SO42-的物质的量浓度为c(SO42-)=$\frac{n}{V}$=$\frac{3a}{112}$mol/L;
(4)①依据化学反应方程式Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4计算即可;
②根据C=$\frac{n}{V}$,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
解答 解:(1)银离子与硫酸根生成硫酸银沉淀从而不能共存,硫酸铁为电解质溶液与氢氧化铁胶体形成聚沉,故答案为:①⑤;
(2)Fe2(SO4)3溶液和Ba(OH)2溶液反应生成硫酸钡沉淀和氢氧化铁红褐色沉淀,故离子反应方程式为:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓BaSO4↓,
故答案为:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓BaSO4↓;
(3)1L Fe2(SO4)3溶液中,含有Fe3+ ag,则n(Fe3+)=$\frac{ag}{56g/mol}$=$\frac{a}{56}$mol,根据化学式可得SO42-的物质的量为n(SO42-)=$\frac{3}{2}$×n(Fe3+)=$\frac{3}{2}$×$\frac{a}{56}$mol,c(SO42-)=$\frac{3amol}{112×1L}$=$\frac{3a}{112}$mol/L,取出0.25L该溶液,体积减小,浓度不变,c(SO42-)=$\frac{3a}{112}$mol/L,
故答案为:$\frac{3a}{112}$mol/L;
(4)①Fe2(SO4)3溶与NaOH溶液反应方程式为:Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4,即1molFe2(SO4)3~6molNaOH,12g 10%的NaOH溶液物质的量为:$\frac{12g×10%}{40g/mol}$=0.03mol,故n[Fe2(SO4)3]=0.005mol,n=cV,故V=$\frac{n}{c}$=$\frac{0.005mol}{0.05mol/L}$=0.1L=100mL,
故答案为:100;
②该同学用新配制的Fe2(SO4)3溶液与含12g 10%的NaOH溶液恰好完全反应时,发现所需体积比①中所求的体积偏小,故所配溶液的浓度偏大,
A.配制溶液时,未洗涤烧杯,故物质的量减小,故浓度偏小,故A错误;
B.配制溶液时,未冷却至室温,立即配制完,故导致水体积减小,故浓度偏大,故B正确;
C.配制溶液时,俯视容量瓶刻度线,故水体积偏小,故浓度偏大,故C正确;
D.加水时超过刻度线,用胶头滴管吸出,导致浓度偏小,故D错误;
故答案为:BC.
点评 本题主要考查的是一定物质的量浓度溶液的配制以及误差分析,属于常考题,题目难度不大,注意从c=$\frac{n}{V}$理解配制原理.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:填空题
常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0 %的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。
(1)该混合溶液的质量分数为 。
(2)该混合溶液的物质的量浓度是 mol·L-1
(3)在1000 g水中溶解 mol NaCl才能使其浓度与上述混合溶液的浓度相等。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:实验题
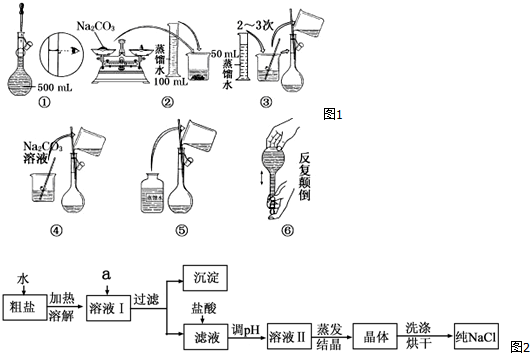
人们获得食盐的方式有多种,最主要的是海水晒盐。通过海水晾晒得到的粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验流程(试剂以化学式表示)

(1)BaCl2、NaOH、Na2CO3的加入顺序,必须保证___________在____________后
(2)溶解、过滤、蒸发过程中都使用到的玻璃仪器是_______ _________,蒸发时玻璃棒的作用是______________________
(3)经过⑤步骤之后得到的沉淀的成分为:________________________
(4)制得的精盐中不小心混入了硝酸钾晶体,用电子天平称取8.00g样品溶于水,向溶液中加入足量硝酸银溶液,将产生的沉淀过滤、洗涤、干燥,并称得其质量为14.35g,则该样品中氯化钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
将5mol/L盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度为
A.0.05mol/L B.0.25mol/L C.0.1mol/L D.0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定终点的pH值一定等于7 | |
| B. | 滴定实验中锥形瓶不可用待测液润洗 | |
| C. | 滴定实验中,KMnO4溶液应放在碱式滴定管中 | |
| D. | 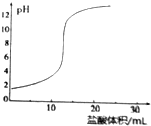 用盐酸滴定NaOH溶液的滴定曲线如图所示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com