
关于下列各图的叙述,正确的是( )
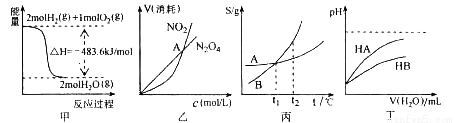
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2016-2017学年宁夏高二上月考二化学卷(解析版) 题型:实验题
(1)准确量取25.00mL高锰酸钾溶液,可选用的仪器是 .
(A)50mL 量筒 (B)10mL量筒 (C)50mL 酸式滴定管 (D)50mL碱式滴定管
(2) 进行中和滴定时,事先不应 该用所盛溶液润洗的仪器是 .
该用所盛溶液润洗的仪器是 .
(A)酸式滴定管 (B)碱式滴定管 (C)锥形瓶 (D)量筒
某烧碱样品中含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
(A)在托盘天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解;
(B)在250mL的容量瓶中定容配制250mL烧碱溶液;
(C)用移液管移取25mL烧碱溶液于锥形瓶中,并滴入几滴甲基橙作指示剂;
(D)将物质的量浓度为cmol•L﹣1的标准硫酸溶液装入已润洗过的酸式滴定管中,调整液面并记下起始读数为V1mL;
(E)在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数为V2mL.
就此完成下列问题:
(3)观察滴定管里液面的高度时应注意:滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数精确到 ml
(4)E步骤的操作中在锥形瓶下垫一张白纸的作用是 .
(5)D步骤的操作中液面应调整到 ,尖嘴部分应该充满液体,不能有气泡。
(6)下列操作导致待测烧碱浓度偏高的( )
A. 滴定前仰视,滴定结束时俯视 B. 滴定前有气泡
C. 滴定结束有气泡 D. 未用标准液洗涤滴定管
(7) 该烧碱样品纯度是 .
(8)滴定终点的判定
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷(解析版) 题型:选择题
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是 ( )
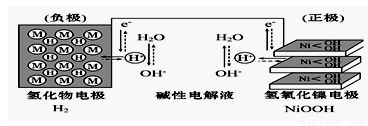
A.放电时电池内部H+向负极移动
B.充电时,将电池的负极与外接电源的正极相连
C.充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O
D.放电时负极的电极反应式为MHn-ne- = M+nH+
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上11.27周考化学卷(解析版) 题型:推断题
(12分)I.甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X(一种钠盐)溶液鉴别它们,已知气体B的密度在同温同压下是氢气密度的22倍。试根据下图中的转化关系回答问题:
(1)下列物质的化学式分别为:甲____________、丙_____________、丁__________;
(2)戊的电子式为________________________;
(3)写出白色沉淀A与乙反应的离子方程式为__________________________。
II.已知:工业制备二甲醚的催化反应室中进行下列反应
CO(g)+2H2(g) CH3OH(g)△H=-90.7kJ/mol①
CH3OH(g)△H=-90.7kJ/mol①
2CH3OH(g) CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CO(g)+H2O(g) CO2(g)+H2(g)△H=-41.2kJ/mol③
CO2(g)+H2(g)△H=-41.2kJ/mol③
催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H= _____________。
CH3OCH3(g)+CO2(g)的△H= _____________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上11.27周考化学卷(解析版) 题型:选择题
下列元素一定属于主族元素的是
A. 位于元素周期表IIA族右边的元素
B. 原子核外最外层上有两个电子的元素
C. 原子核外最外层为8电子稳定结构的元素
D. 2010年科学家首次合成的第116号元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:实验题
某溶液的溶质离子可能含有Mg2+、Ba2+、CO32-、Cl-、SO42-、NO3-中的几种,现进行如下实验:
1.取适量溶液,加入足量NaOH溶液,生成白色沉淀;
2.过滤,向实验1所得的滤液中加入足量H2SO4溶液,有白色沉淀生成。根据上述实验回答下列问题。
(1)溶液中一定不存在的离子是
(2)写出1和2中所发生反应的离子方程式
(3)为了验证溶液中是否存在Cl-、NO3- ,某同学提出下列假设:
①只存在Cl- ;②Cl-、NO3-同时存在;③ 。
已知实验提供的试剂只有稀盐酸、AgNO3溶液、稀硝酸、NaOH溶液和蒸馏水。
实验方法:
实验 现象:
现象:
实验结论:假设③正确
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
用0.1mol/L的Na2SO3溶液30mL恰好将0.002mol的XO4-还原(Na2SO3中S元素体现还原性),元素X在还原产物中的化合价是
A.+1 B.+2 C.+3 D.+4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓[
B.稀硫酸与铁粉反应:2Fe+6H+= 2Fe3++3H2↑
2Fe3++3H2↑
C.盐酸与氢氧化钠溶液 反应:H++OH-=H2O
反应:H++OH-=H2O
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
下列关于物质分类的正确组合是( )
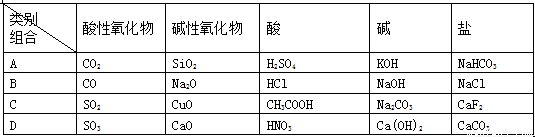
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | CuO | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com