
| A. | Na2CO3→NaHCO3 | B. | Fe→FeCl2 | C. | NaCl→Na | D. | Al2O3→Al(OH)3 |
分析 A、碳酸钠与二氧化碳水溶液反应生成碳酸氢钠;
B、铁与三氯化铁反应生成氯化亚铁;
C、电解熔融氯化钠可以生成钠;
D、Al2O3到Al(OH)3不能一步反应实现.
解答 解:A、碳酸钠与二氧化碳水溶液反应生成碳酸氢钠,可以一步实现,符合题意要求,故不选;
B、铁与三氯化铁反应生成氯化亚铁,可以一步实现,符合题意要求,故不选;
C、电解熔融氯化钠可以生成钠,能一步反应实现,符合题意,故不选;
D、氧化铝属两性氧化物,能与酸或者碱发生复分解反应生成盐和水.上述反应中没有Al(OH)3这种碱的生成,因此由Al2O3到Al(OH)3不能一步反应实现,故选;
故选D.
点评 熟练掌握常见物质的性质与变化规律,是解答此类问题的基本的知识基础.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
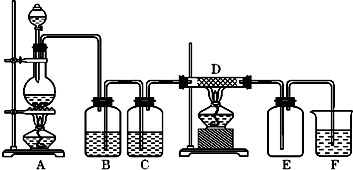
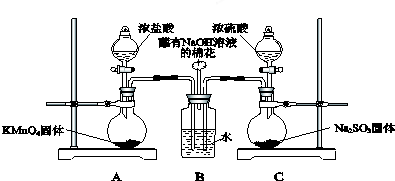
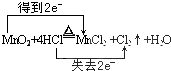 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离方程式:Na2SO4═Na2++SO42- | B. | 氯化钠的电子式: | ||
| C. | 14C的原子结构示意图: | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 原因 |
| A | Fe与稀HNO3、稀H2SO4反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | 重金属盐中毒可服用牛奶解毒 | 牛奶中蛋白质变性,保护了人体的蛋白质 |
| D | 明矾用来净水 | Al3+水解生成Al(OH)3胶体,具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铁与稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+2Ag+═2Ag+Cu2+ | |
| D. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com