
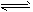 Cr(OH)3������ɫ��
Cr(OH)3������ɫ�� CrO22-������ɫ��+H++H2O����0. 05mol/LCr2(SO4)3��Һ50mL�У�����1.0mol/L NaOH��Һ50mL��ַ�Ӧ����Һ�ɹ۲쵽��������
CrO22-������ɫ��+H++H2O����0. 05mol/LCr2(SO4)3��Һ50mL�У�����1.0mol/L NaOH��Һ50mL��ַ�Ӧ����Һ�ɹ۲쵽�������� ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�츣��ʡ�߶��ڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��Cr2(SO4)3��ˮ��Һ�м���NaOH��Һ����pH =4.6ʱ����ʼ����Cr(OH)3����������pH�����ߣ��������ࣻ����pH��13ʱ��������ʧ����������ɫ���Ǹ�������ӣ�CrO22-������ƽ���ϵ���£�
Cr3+��3OH- Cr(OH)3
Cr(OH)3 CrO22- + H+
+ H2O
CrO22- + H+
+ H2O
����ɫ�� ������ɫ�� ������ɫ��
��0. 05mo1��L-1 Cr2(SO4)3��Һ50mL�У�����1.0mol��L-1NaOH��Һ50mL����ַ�Ӧ����Һ�пɹ۲쵽�������� ��lg2=0.3�� �� ��
A.��ҺΪ��ɫ B.��Һ���л���ɫ����
C.��ҺΪ����ɫ D.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ӱ�ʡ�߶���һ�ε��п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Cr2(SO4)3��ˮ��Һ�У�����NaOH��Һ����pH=4.6ʱ����ʼ����Cr(OH)3����������pH�����ߣ��������࣬����pH��13ʱ��������ʧ����������ɫ���Ǹ�������ӣ�CrO2-������ƽ���ϵ���£�Cr3+
+ 3OH-  Cr(OH)3
Cr(OH)3
 CrO2-
+ H+ + H2O
CrO2-
+ H+ + H2O
(��ɫ) ������ɫ�� ������ɫ��
��50mL0.05mol��L-1��Cr2(SO4)3��Һ�У�����1.0mol��L-1��NaOH��Һ50mL����ַ�Ӧ����Һ�пɹ۲쵽������Ϊ�� ��
A.��ҺΪ��ɫ B.��Һ���л���ɫ����
C.��ҺΪ����ɫ D.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�츣��ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ�ѡ����
��Cr2(SO4)3��ˮ��Һ�м���NaOH��Һ����pH =4.6ʱ����ʼ����Cr(OH)3����������pH�����ߣ��������ࣻ����pH��13ʱ��������ʧ����������ɫ���Ǹ�������ӣ�CrO22-������ƽ���ϵ���£�
Cr3+��3OH- Cr(OH)3
Cr(OH)3 CrO22- + H+ +
H2O
CrO22- + H+ +
H2O
����ɫ�� ������ɫ�� ������ɫ��
��0. 05mo1��L-1 Cr2(SO4)3��Һ50mL�У�����1.0mol��L-1NaOH��Һ50mL����ַ�Ӧ����Һ�пɹ۲쵽�������� �� ��
A.��ҺΪ��ɫ B.��Һ���л���ɫ����
C.��ҺΪ����ɫ D.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010���㽭ʡ�߶��ڶ�ѧ�����п��ԣ���ͨ�ࣩ��ѧ���� ���ͣ�ѡ����
��Cr2(SO4)3��ˮ��Һ�м�������������Һ����pH=4.6ʱ����ʼ����Cr(OH)3����������pH�����߳������࣬��pH��13ʱ��������ʧ����������ɫ���Ǹ�������ӣ�CrO2������ƽ���ϵ���£� Cr3+(��ɫ)+3OH�� 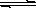 Cr(OH)3(����ɫ)
Cr(OH)3(����ɫ)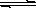 CrO2��(����ɫ)+H++H2O
CrO2��(����ɫ)+H++H2O
��0.05mol/LCr2(SO4)3����Һ50mL�м���1.0mol/L��NaOH��Һ50mL����ַ�Ӧ����Һ�пɹ۲쵽������Ϊ
A����ҺΪ��ɫ B����Һ���л���ɫ���� C����ҺΪ����ɫ D�����ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10��̨���и߶���ѧ����ĩ���Ի�ѧ�� ���ͣ�ѡ����
�� Cr2 (SO4)3 ��ˮ��Һ�м���NaOH��Һ����pH=4.6ʱ��ʼ����Cr(OH)3 ����������pH�����ߣ��������࣬��pH��13ʱ��������ʧ�������Ǹ�������ӣ�CrO2��������ƽ���ϵ��
Cr3+ + 3OH��Cr(OH)3 CrO2��+ H++H2O
(��ɫ) ������ɫ�� ������ɫ��
��50mL 0.05 mol��L��1��Cr2(SO4)3 ��Һ�м�������1.0mol��L��1�� NaOH��Һ����ַ�Ӧ����Һ�пɹ۲쵽������Ϊ
A. ��ҺΪ��ɫ B. ��ҺΪ����ɫ
C. ��Һ���л���ɫ���� D. ���ж�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com