
| ||
(
| ||
| (400-36.5)g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
铅蓄电池属于二次电池,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸,工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;PbSO4不溶。
(1)该蓄电池工作时负极的电极反应式为
(2)将质量相等的铁棒和石墨棒分别插入CuSO4溶液中,铁棒接该蓄电池Pb极,石墨棒接该蓄电池PbO2极,一段时间后测得铁棒比石墨棒增加了3.2克,则CuSO4溶液质量 (增加、减少) 克;如果要求将CuSO4溶液恢复成与开始时完全相同,则可以加入下列物质中的
A.CuSO4溶液 B.CuCO3固体 C.CuO固体 D.Cu(OH)2固体
E.Cu固体 F. Cu2(OH) 2CO3固体
(3)若用该蓄电池作电源(都用惰性材料做电极)电解400克饱和食盐水,如果电池内硫酸的的体积为5升,当其浓度从1.5mol/L降至1.3mol/L时,计算剩余溶液中氯化钠的质量分数(该温度下氯化钠的溶解度为32克)。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年江苏省盐城中学高一第二学期期末考试化学试卷 题型:计算题
铅蓄电池属于二次电池,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸,工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;PbSO4不溶。
(1)该蓄电池工作时负极的电极反应式为
(2)将质量相等的铁棒和石墨棒分别插入CuSO4溶液中,铁棒接该蓄电池Pb极,石墨棒接该蓄电池PbO2极,一段时间后测得铁棒比石墨棒增加了3.2克,则CuSO4溶液质量 (增加、减少) 克;如果要求将CuSO4溶液恢复成与开始时完全相同,则可以加入下列物质中的
| A.CuSO4溶液 | B.CuCO3固体 | C.CuO固体 | D.Cu(OH)2固体 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省安庆市高三4月联考理综化学试卷(解析版) 题型:选择题
铅蓄电池属于二次电池。下图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。电池反应为:Pb+PbO2+4H++2SO42— 2PbSO4+2H2O
2PbSO4+2H2O
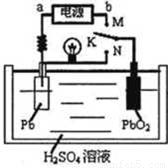
下列有关说法正确的是
A.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,若制得氯气2.24L,则电池内消耗的H2SO4的物质的量是 0.2mol
B.K与N相接时,H+向正极区迁移
C.K与M连接时,所用电源的b极为负极
D.K与M相接时,阳极附近的pH逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com