
【题目】H2X 和H2Y均为二元弱酸,常温下,将NaOH 溶液分别加到H2X 和H2Y的溶液中,在不同pH 环境下不同形态的粒子(即酸、酸式酸根、酸根离子)的组成分数如图所示:
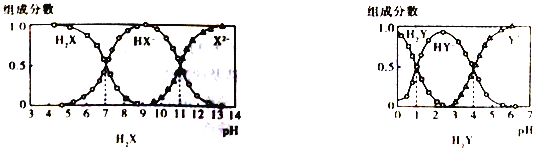
下列说法正确的是
A. 在pH=7的溶液中HX-、X2-、HY-和Y2-能大量共存
B. 向Na2X溶液中加入少量H2Y 溶液,发生反应:X2-+H2Y==HX-+HY-
C. 1L.0.1mol·L-1NaHY溶液中n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-的水解平衡常数为Kb=10-7
【答案】D
【解析】根据图中信息可知,pH=7时,c(H2X)=c(HX-),Ka1(H2X)= 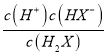 =
= ![]() =10-7mol/L;pH=11时,c(HX-)=c(X2-),Ka2(H2X)=
=10-7mol/L;pH=11时,c(HX-)=c(X2-),Ka2(H2X)= 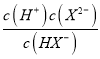 =
= ![]() =10-11mol/L;pH=1时,c(H2Y)=c(HY-),Ka1(H2Y)=
=10-11mol/L;pH=1时,c(H2Y)=c(HY-),Ka1(H2Y)= 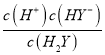 =
= ![]() =10-1mol/L;pH=4时,c(HY-)=c(Y2-),Ka2(H2Y)=
=10-1mol/L;pH=4时,c(HY-)=c(Y2-),Ka2(H2Y)= 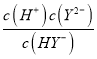 =
= ![]() =10-4mol/L;根据电离平衡常数可知,Ka1(H2Y)> Ka2(H2Y)> Ka1(H2X)> Ka2(H2X)。A. HY-能与HX-、X2-反应而不能大量共存,选项A错误;B. 向Na2X溶液中加入少量H2Y 溶液,发生反应:2X2-+H2Y==2HX-+ Y2-,选项B错误;C. 根据物料守恒,1L.0.1mol·L-1NaHY溶液中n(HY-)+n(Y2-)+n(H2Y) =0.1mol,选项C错误;D. HX-的水解方程式为:HX-+H2O
=10-4mol/L;根据电离平衡常数可知,Ka1(H2Y)> Ka2(H2Y)> Ka1(H2X)> Ka2(H2X)。A. HY-能与HX-、X2-反应而不能大量共存,选项A错误;B. 向Na2X溶液中加入少量H2Y 溶液,发生反应:2X2-+H2Y==2HX-+ Y2-,选项B错误;C. 根据物料守恒,1L.0.1mol·L-1NaHY溶液中n(HY-)+n(Y2-)+n(H2Y) =0.1mol,选项C错误;D. HX-的水解方程式为:HX-+H2O![]() H2X+OH-,平衡常数为Kb=
H2X+OH-,平衡常数为Kb=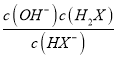 =
=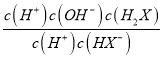 =
=![]() =10-7,选项D正确。答案选D。
=10-7,选项D正确。答案选D。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
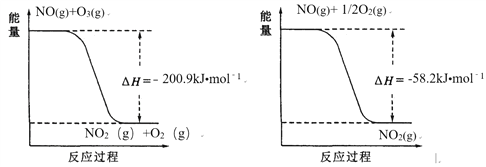
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
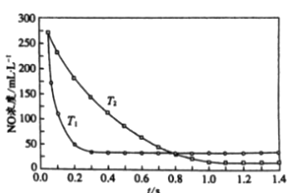
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
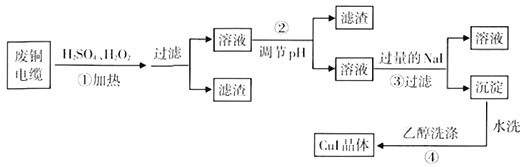
(1)过程①得到的溶液呈蓝色,其原因是______(用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________。
(2)过程②调节溶液pH适宜选用的试剂是_______(填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________。
(4)过程④用乙醇洗涤沉淀的目的为________________。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______(已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用下列装置(仪器可重复使用)制备PH3并证明PH3具有强还原性和热不稳定性。已知: ①标准状态时PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃; ②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃;③乙醚是一种易挥发的液体,沸点34.6℃,能溶解白磷。
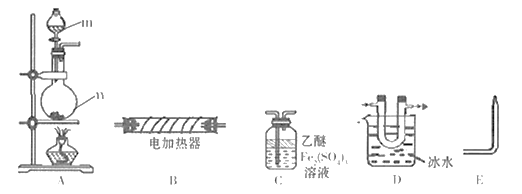
(1)仪器m的名称为_________,装置C名称为____________。
(2)实验室用白磷与NaOH浓溶液反应生成NaHPO2的同时制得PH3,反应的化学方程式为___________。
(3)用装置A制取PH3,实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是___________。
(4)将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有____性,装置C中发生的化学反应方程式为_________,点燃E处气体的目的为______________。
(5)将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为
A![]()
![]() D
D![]()
![]() ______
______![]() E( 在“
E( 在“![]() ”之间的空白处填写装置编号)。
”之间的空白处填写装置编号)。
能证明PH3分解的气体产物的现象是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是
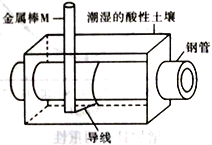
A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M 将电子通过导线流向钢管
C. 在潮湿的酸性土壤中H+向金属棒M 移动,抑制H+与铁的反应
D. 金属棒M 与钢管用导线连接后可使钢管表面的腐蚀电流接近于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hagemann酯的合成路线如下(部分反应条件略去):

(1)Hagemann酯的分子式为_____________。
(2)已知A→B、B→C均为加成反应,则B的结构简式是__________。
(3)E→F的化学方程式是_______________。
(4)已知Hagemann酯的一种同分异构体有下列结构特征:
①含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为____________。
(5)下列说法正确的是________________。
①G为芳香族化合物
②A能和HCl加成得到聚氯乙烯的单体
③G与NaOH溶液共热,能得到甲醇
④在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的沸点为100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是( )
A. 范德华力 B. 共价键 C. 氢键 D. 相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是巧克力、蜂蜜香精的配料,其合成路线如下:

已知:
①一个碳原子上同时连接两个羟基,立即失去一分子水,生成另一种物质,如:![]()
②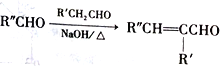
(1)A的化学名称是________________,M中官能团的名称为___________________。
(2)K与H的关系是__________________________。
(3)C分子结构中最多_________个原子共平面。
(4)J的结构简式为__________________________。
(5)G生成H的化学方程式为_______________________________。反应类型为_________________。
(6)同时满足下列条件的E的同分异构体共有__________________种。
①能与FeCl3溶液显紫色 ②能发生银镜反应 ③能与溴水发生加成反应而褪色
(7)以对二甲苯与乙醛为原料,结合已知信息选用必要的无机物合成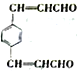 ,设计合理的合成路线:______________________________________。合成流程图示例如下:CH2=CH2
,设计合理的合成路线:______________________________________。合成流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL 稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol/L.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A. 0.15mol/L B. 0.24mol/L C. 0.30mol/L D. 0.36mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com