
分析 (1)氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子;
(2)根据当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解,求出原溶液中铝离子的浓度,根据电荷守恒计算原溶液中钾离子的浓度,再加上所加KOH的中钾离子的物质的量,可计算反应后钾离子的总浓度.
解答 解:(1)①反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故答案为:I->Fe2+>Br-;
②还原性I->Fe2+>Br-,有1mol FeI2和2mol FeBr2的溶液中含有3molFe2+,2molI-,4molBr-,通入2mol Cl2,首先氧化I-,其次氧化2molFe2+,
故答案为:I-、Fe2+;
(2)体积均为1L,铝离子的物质的量是x
由于生成沉淀完全溶解,所以反应为
Al3++4OH-=AlO2-+2H2O
1 4
x 0.4mol
得x=0.1mol,即含有0.1molAl3+,
原溶液中只含有K+,Al3+和SO42-,根据电荷守恒,则
n(K+)+3n(Al3+)=2n(SO42-),而n(Al3+)=0.1mol,n(SO42-)=0.4mol,
所以n(K+)+3×0.1mol=2×0.4mol,得n(K+)=0.5mol,
而反应时又KOH引入了0.4molK+,所以K+总量为0.9mol,此时溶液体积变为2L,故c(K+)=0.45mol/L,
故答案为:0.45.
点评 本题综合考查氧化还原反应以及有关混合物的计算,侧重于学生的分析、计算能力的考查,题目难度不大,注意根据质量守恒和电荷守恒的角度解答是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气中含有2NA个氢原子 | |
| C. | 1molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
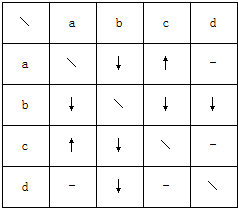
| A. | a可能是NaHCO3溶液 | B. | b一定是Ba(OH)2溶液 | ||
| C. | c一定是稀硫酸 | D. | d一定是MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2既是氧化剂,又是还原剂 | |
| B. | 还原产物与氧化产物的物质的量之比为5:1 | |
| C. | 当转移了3 mol电子时,反应消耗了3 mol的Cl2 | |
| D. | 反应中NaOH提供了碱性环境,但它既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 电解后溶液pH=0 | B. | a=3 | ||
| C. | 阳极生成1.5mol Cl2 | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
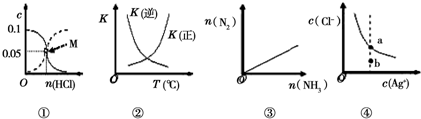
| A. | 图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化.实现表示c(NH3•H2O),虚线表示c(NH4+),处于M点时溶液呈中性 | |
| B. | 图②表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. | 图③表示2NH3(g)?N2(g)+3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 | |
| D. | 图④表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀中氢氧根的质量为5.1g | B. | V为2.24L | ||
| C. | Cu的物质的量为0.1mol | D. | 反应后溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com