
【题目】下列有关物质分类或归类正确的一组是( )
①液氯、干冰、磁性氧化铁均为化合物
②氢氟酸、盐酸、水玻璃均为混合物
③明矾、小苏打、烧碱均为电解质
④牛奶、豆浆、漂粉精均为胶体
⑤Na2O2、Na2CO3、Na2SiO3均为钠盐
A.①② B.②③ C.③④ D.②③⑤
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. a—定由W、X两种元素组成
D. 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 氯气跟氯化亚铁溶液反应生成氯化铁:Fe2++Cl2=Fe3++2Cl-
B. 铜跟稀硝酸反应,产物之一是硝酸铜:Cu+2H+=Cu2++H2↑
C. 碳酸氢钠溶液跟醋酸反应:HCO3-+H+=CO2↑+H2O
D. 碳酸钙跟稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某种盐后铜粉逐渐溶解,这种盐是( )
A.NaCl B.KNO3 C.K2SO4 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.步骤(2)产物中残留的烯丙醇可用溴水检验
C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)已知反应I: 2SO2(g)+O2(g)![]() 2SO3(g),△H=-196.6kJ·mol-1
2SO3(g),△H=-196.6kJ·mol-1
反应II: 2NO(g)+O2(g)![]() 2NO2(g),△H=-113.0kJ·mol-1
2NO2(g),△H=-113.0kJ·mol-1
则SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热反应方程式为________。
(2)①若在绝热恒容密闭容器中通入一定量的SO2和O2,一定条件下发生反应I,一段时间内,正反应速率随时间变化曲线如右图所示,则在a点时,反应______(填“达到”或“未达到”)平衡状态;t1~t3时间内,v正先增大后减小的主要原因是___________。

②若在两个相同绝热恒容密闭容器中分别加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),其它条件相同,发生反应I,达到平衡时,则该反应的平衡常数:A _____B(填“>”、“=”、“< ” )。
(3)已知常温下,H2S的电离常数:K1=1.3×10-7, K2=7.1×10-15,则0.lmol/LH2S溶液的pH约为_______(取近似整数值);向浓度均为0.001mol·l-1的AgNO3和Hg(NO3)2混合溶液中通入H2S气体,开始生成沉淀的c(S2-)为_______。(已知:Ksp(Ag2S)=6.3×10-50,Ksp(HgS)=1.6×10-52)
(4)NH3催化还原氮氧物技术(SCR)是目前应用广泛的烟气氮氧化物脱除技术。现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1 ;Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
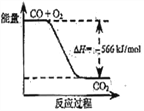
A. CO的燃烧热为283 kJ
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离和提纯的方法错误的是( )
A. 用溶解、过滤法分离氯化钾和二氧化锰的固体混合物
B. 用结晶法分离氯酸钾和氯化钠的固体混合物
C. 用加酒精萃取的方法提取溴水中的溴
D. 用蒸馏法分离酒精和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |
则K1,K2,K3之间的关系为K2=______________,△H3=_____________
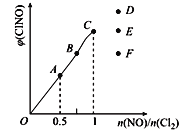
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
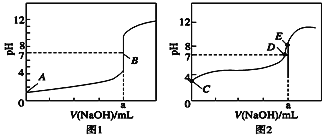
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。
(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com