
分析 磁性材料A由两种元素组成,A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,则A由铁元素和硫元素组成,取2.960gA在足量的空气中充分锻烧,得到2.4g红棕色固体B应为Fe2O3,和无色刺激性气体D判断为SO2,固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色,说明C为氯化铁溶液,气体D溶于水得到无色酸性溶液E为H2SO3,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强,为硫酸和氢碘酸,据此分析回答问题.
(1)分析可知A中含铁元素和硫元素;
(2)溶液C为氯化铁溶液处理污水是利用氯化铁水解生成了氢氧化铁胶体,具有吸附悬浮杂质的作用;
(3)化合物A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,依据质量关系计算化合物分子式,和硫酸反应生成硫化氢、硫酸亚铁和单质硫;
(4)E中加足量碘的碘化钾溶液后溶液酸性增强是因为亚硫酸被碘单质氧化为硫酸,溶液中生成碘化氢也为强酸;
解答 解:磁性材料A由两种元素组成,A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,则A由铁元素和硫元素组成,取2.960gA在足量的空气中充分锻烧,得到2.4g红棕色固体B应为Fe2O3,和无色刺激性气体D判断为SO2,固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色,说明C为氯化铁溶液,气体D溶于水得到无色酸性溶液E为H2SO3,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强,为硫酸和氢碘酸,
(1)分析可知A中含铁元素和硫元素,组成元素为:Fe,S,故答案为:Fe,S;
(2)溶液C为氯化铁溶液处理污水是利用氯化铁水解生成了氢氧化铁胶体,具有吸附悬浮杂质的作用,反应的离子方程式为:Fe3++3H2O=Fe(OH)3+3H+,
故答案为:Fe3++3H2O=Fe(OH)3+3H+;
(3)化合物A能与稀硫酸反应,反应后得到浅绿色溶液为硫酸亚铁溶液,同时生成一种淡黄色不溶物位S和一种臭鸡蛋气味气体为H2S,依据质量关系计算化合物分子式,取2.960gA在足量的空气中充分锻烧,得到2.4g红棕色固体B为氧化铁,物质的量=$\frac{2.4g}{160g/mol}$=0.015mol,铁元素为0.015mol×2=0.03mol,含硫元素物质的量=$\frac{2.960g-0.03mol×56g/mol}{32g/mol}$=0.04mol,则化学式为:Fe3S4,和硫酸反应生成硫化氢、硫酸亚铁和单质硫,反应的化学方程式为:Fe3O4+3H2SO4=3H2S↑+3FeSO4+S↓,
故答案为:Fe3O4+3H2SO4=3H2S↑+3FeSO4+S↓;
(4)E中加足量碘的碘化钾溶液后溶液酸性增强是因为弱酸亚硫酸被碘单质氧化为硫酸,溶液中生成碘化氢也为强酸,反应的离子方程式为:H2SO3+I2+H2O=SO42-+4H++2I-,
故答案为:H2SO3+I2+H2O=SO42-+4H++2I-;原来部分电离的弱酸亚硫酸被氧化为完全电离的强酸硫酸,且碘单质被还原为HI为强酸.
点评 本题考查了物质组成、物质性质、反应现象和产物的分析判断,掌握基础是解题关键,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述两种溶液分别用水稀释m、n倍,溶液的pH都变成3,则m>n | |
| B. | 上述两种溶液分别与足量的Zn完全反应,产生的H2一样多 | |
| C. | 上述两种溶液分别与等浓度的氢氧化钠溶液恰好反应,消耗氢氧化钠溶液的体积相同 | |
| D. | 1mol/L的盐酸和1mol/L的醋酸的混合溶液与氢氧化钠溶液恰好完全反应时,反应后溶液中c(CH3COO-)+C(Cl-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
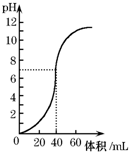 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A. | 1mol•L-1,60mL | B. | 0.5mol•L-1,80mL | C. | 0.5mol•L-1,40mL | D. | 1mol•L-1.80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 250C101KPa条件下,1摩尔任何气体的体积都是22.4升 | |
| B. | 标准状况下,体积是22.4升的物质,其物质的量一定是1摩尔 | |
| C. | 同温同压下两种气体,只要分子数相同,所占体积相同,质量也相同 | |
| D. | 同质量的O2和O3所含的氧原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com