
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H= +216.4 kJ /mol
CO(g)+3H2(g) △H= +216.4 kJ /mol
b.CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H =-41.2 kJ/mol
CO2(g)+H2(g) △H =-41.2 kJ/mol
则反应CH4(g) +2H2O(g)![]() CO2(g)+4H2(g) △H=_________。
CO2(g)+4H2(g) △H=_________。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。

①恒压时,反应一定达到平衡状态的标志是______(填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.c(H2)/c(NH3) 比值保持不变 D.c(NH3)/c(N2) 等于2
②P1_____P2 (填“ > ”、“< ”、“=”,下同);反应平衡常数:B点____D点;
③在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:υ(A)______ υ(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式__________;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O![]() N2H5++OH- K1= 1×10-a;
N2H5++OH- K1= 1×10-a;
N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________(用含a、b式子表示)。
【答案】+175.2kJ/mol BC < > < 2NH3+NaClO![]() N2H4+NaCl+H2O (14-b,14-a)
N2H4+NaCl+H2O (14-b,14-a)
【解析】
(1)由盖斯定律计算;
(2)①根据平衡状态的特点逐项分析;
②合成氨是气体体积减小的反应;合成氨是放热反应;
③B点温度高、压强大反应速率快。
(3)①NaClO将氨氧化成肼,由此写出NH3和NaClO 反应生成N2H4的化学方程式。
②根据平衡常数计算。
(1)由盖斯定律计算,a.CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H= +216.4 kJ /mol,b.CO(g) +H2O(g)
CO(g)+3H2(g) △H= +216.4 kJ /mol,b.CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H =-41.2 kJ/mol,a+b得:则反应CH4(g) +2H2O(g)
CO2(g)+H2(g) △H =-41.2 kJ/mol,a+b得:则反应CH4(g) +2H2O(g)![]() CO2(g)+4H2(g) △H=+216.4 kJ /mol-41.2 kJ/mol=+175.2kJ/mol;
CO2(g)+4H2(g) △H=+216.4 kJ /mol-41.2 kJ/mol=+175.2kJ/mol;
(2)①A、当投料比与计量数相同时,N2和H2的转化率恒相等,不能判断化学反应是否达到化学平衡,故A错误;
B、混合气体的密度为ρ=m/V,反应前后气体总质量不变,容器容积改变,建立平衡过程中混合气体密度发生变化,反应体系密度保持不变能说明化学反应达到化学平衡,故B正确;
C.两者浓度变化相反,c(H2)/c(NH3) 比值保持不变,能说明化学反应达到化学平衡,故C正确;
D.c(NH3)/c(N2) 等于2,不能判断化学反应是否达到化学平衡,故D错误;
故选BC。
②合成氨是气体体积减小的反应,由图知相同温度下P2时氨的体积分数大,压强高,P1<P2;
合成氨是放热反应,D点温度高,平衡常数小,反应平衡常数:B点>D点;
③在A、B两点条件下,B点温度高、压强大反应速率快,该反应从开始到平衡时生成氨气平均速率:υ(A)< υ(B)。
(3)①NaClO将氨氧化成肼,由此写出NH3和NaClO 反应生成N2H4的化学方程式:2NH3+NaClO![]() N2H4+NaCl+H2O。
N2H4+NaCl+H2O。
②25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+)。
N2H4+H2O![]() N2H5++OH- K1= 1×10-a,K1=c(OH- )c(N2H5+)/c(N2H4),c(N2H5+)>c(N2H4),c(N2H5+)/c(N2H4)=K1/c(OH- )>1,K1>c(OH- ),c(OH- )<1×10-a,pH<14-a;
N2H5++OH- K1= 1×10-a,K1=c(OH- )c(N2H5+)/c(N2H4),c(N2H5+)>c(N2H4),c(N2H5+)/c(N2H4)=K1/c(OH- )>1,K1>c(OH- ),c(OH- )<1×10-a,pH<14-a;
N2H5++H2O![]() N2H62++OH- K2=1×10-b,K2=c(OH- )c(N2H62+)/c(N2H5+),c(N2H5+)>c(N2H62+),c(N2H62+)/c(N2H5+)=K2/c(OH- )<1,K2<c(OH- ),c(OH- )>1×10-b,pH>14-b;
N2H62++OH- K2=1×10-b,K2=c(OH- )c(N2H62+)/c(N2H5+),c(N2H5+)>c(N2H62+),c(N2H62+)/c(N2H5+)=K2/c(OH- )<1,K2<c(OH- ),c(OH- )>1×10-b,pH>14-b;
应控制溶液pH范围为(14-b,14-a)。


科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分
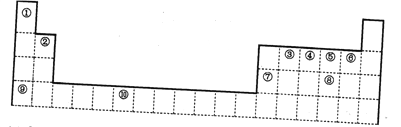
(1)②号元素原子的电子式_________________
(2)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式___________________________
(3)元素③和⑤可以原子个数比1:2 形成化合物,请在①-⑩号元素中选择元素组合,写出与它互为等电子体的一种分于化学式___________、一种离子的化学式__________________。
(4)⑩号元素的+3 价离子能与④、⑤的氢化物形成配位数为6 的络合物。且相应两种配体的物质的量之比为2:1,写出配离子的化学式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法中,错误的是( )
A. 原电池是一种将化学能直接转化为电能的装置B. 原电池中,正极发生氧化反应
C. 原电池的电子从负极经导线流向正极D. 原电池的负极材料一般比正极活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
有下列物质:
①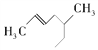 ②
②![]() ③
③![]() ④C4H8
④C4H8
⑤CH2==CH—CH==CH2 ⑥C3H6 ⑦![]() ⑧
⑧![]()
⑨HOCH2CH2COOH ⑩HOCH2OCH2CHO
(1)其中互为同系物的是____________________(填序号),互为同分异构体的是____________________(填序号)。
(2)写出⑦与HCl一定条件下发生1,4加成反应的化学方程式_______________________。
(3)用系统命名法给物质①和物质⑧命名。
① ___________________________。
___________________________。
⑧ ![]() ____________________________。
____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制碱厂的生产流程示意图如下:

下列分析正确的是( )
A. 该制碱法是侯氏制碱法 B. 反应①中包含复分解反应
C. X中只含有Ca2+和Cl— D. 理论上,生产过程中无需补充CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D. P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com