
分析 (1)X的基态原子核外有3个原子轨道充满电子,即1s22s22p4;
(2 )M+中3d能级的轨道在半充满状态,则M+的电子排布式为1s22s22p6 3s2 3p6 3d5;
(3)E元素原子核外有6种不同运动状态的电子,即就有6个电子,为碳元素,最高价为+4价,结合等电子体的定义原子总数相等和价电子总数相等分析解答;
解答 解:(1)X的基态原子核外有3个原子轨道充满电子,即1s22s22p4,所以其价电子排布式为2s22p4,故答案为2s22p4;
(2 )M+中3d能级的轨道在半充满状态,则M+的电子排布式为1s22s22p6 3s2 3p6 3d5,所以其原子的电子排布式为1s22s22p6 3s2 3p6 3d54s1,故答案为:1s22s22p6 3s2 3p6 3d54s1;
(3)E元素原子核外有6种不同运动状态的电子,即就有6个电子,为碳元素,最高价为+4价,所以最高价氧化物的分子的结构式为O=C=O,该分子中σ键为2个,π键为2个,个数之比为1:1,又等电子体为原子总数相等和价电子总数相等,所以与CO2互为等电子体的分子的化学式为CS2或N2O;故答案为:O=C=O,1:1,CS2或N2O;
点评 本题主要考查了元素的推断、核外电子排布以及结构等知识,难度不大,元素推断是解题的关键,答题时注意元素化合物知识的灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
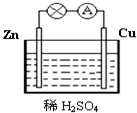 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
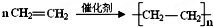 .
.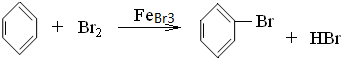 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
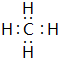 、
、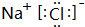
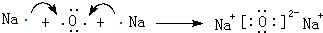 、
、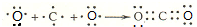
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体扩散速率与扩散面积成正比 | |
| B. | 气体扩散速率与气体溶解度和分子量成正比 | |
| C. | 气体扩散速率与分压差成正比 | |
| D. | 气体扩散速率与温度成正比 | |
| E. | 气体扩散速率与扩散距离成反比 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
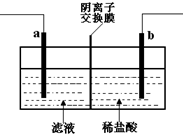 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )| A. | 电解时,电极a应与外电源的正极相连 | |
| B. | 电解时,电极b周围产生无色无味的气体 | |
| C. | 电解时,电极a发生的反应是:2Cl--2e-=Cl2↑ | |
| D. | 电解时,可以用氯化钠溶液替代稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com