
【题目】硝酸钙晶体[Ca(NO3)2·4H2O]常用于电子、仪表及冶金工业。一种利用CaO制备Ca(NO3)2·4H2O的流程如下:
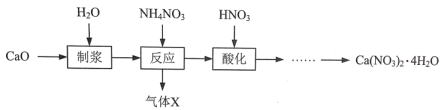
(1)“制浆”过程中发生反应的化学方程式是_________。
(2)“气体X”的化学式是_________ ,生成气体X发生反应的化学方程式是_________。
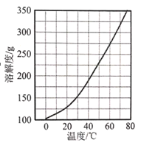
(3)Ca(NO3)2·4H2O的溶解度随温度变化的曲线如图所示,“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加热浓缩、___、 过滤、洗涤、干燥。实验室过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和 ____ 。
【答案】CaO+ H2O=Ca(OH)2 NH3 2NH4NO3 + Ca(OH)2 = Ca (NO3)2+2NH3↑+2H2O 冷却结晶或降温结晶 漏斗
【解析】
“制浆”过程中制浆的时候加入的是氧化钙和水,CaO+ H2O=Ca(OH)2,氢氧化钙与硝酸铵反应生成氨气,2NH4NO3+ Ca(OH)2= Ca (NO3)2+2NH3↑+2H2O,从溶液中获得晶体需要蒸发浓缩,降温结晶,过滤,洗涤,干燥,过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(1)“制浆”过程中制浆的时候加入的是氧化钙和水,发生反应的化学方程式是CaO+ H2O==Ca(OH)2。故答案为:CaO+ H2O==Ca(OH)2;
(2)制浆时生成了Ca(OH)2,氢氧化钙与硝酸铵反应生成氨气,故放出的气体是氨气,“气体X”的化学式是NH3,生成气体X发生反应的化学方程式是2NH4NO3+ Ca(OH)2= Ca (NO3)2+2NH3↑+2H2O。故答案为:NH3;2NH4NO3+ Ca(OH)2= Ca (NO3)2+2NH3↑+2H2O;
(3)从溶液中获得晶体需要蒸发浓缩,降温结晶,过滤,洗涤,干燥,“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加热浓缩、冷却结晶或降温结晶、 过滤、洗涤、干燥。实验室过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和漏斗 。故答案为:冷却结晶或降温结晶;漏斗。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种有机物的结构简式如下所示。

(1)A→C的反应类型是_____。A中含氧官能团的名称______。
(2)上述有机物能发生银镜反应的是____(填代号),互为同分异构体的是____(填代号)。
(3)已知HCHO分子中所有原子都在同一平面内,则上述分子中所有原子有可能都在同一平面的是____(填代号)。
(4)由C形成高聚物的结构简式是_______。
(5)写出由A→D的化学反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
(1)基态B原子的电子排布图为________________________,其第一电离能比Be___________(填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构简式为___________ (标出配位键),其中心原子的杂化方式为________,写出[BH4]-的一种阳离子等电子体_______。
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。

(4)硼酸晶体是片层结构,下图表示的是其中一层的结构。每一层内存在的作用力有_________。

(5)三氯化硼的熔点比氯化镁的熔点低,原因是_______________________。
(6)镁单质晶体中原子的堆积模型如下图,它的堆积模型名称为_______;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量的计算式是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 W 在医药和新材料等领域有广泛应用。W 的一种合成路线如图:
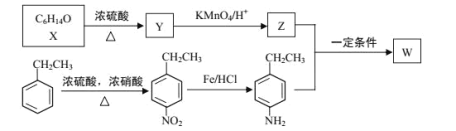
已知部分信息如下:
① | 1molY完全反应生成2molZ,且在加热条件下Z不能和新制氢氧化铜悬浊液反应 |
② |
|
③ | RCH2NH2+ |
请回答下列问题:
(1)Y 的化学名称是___;Z 中官能团的名称是___;
(2)![]() 中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
(3)生成 W 的化学方程式为___。
(4)G 是对硝基乙苯的同分异构体,G 能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为 1∶2∶2∶2∶2 的结构简式为_________________。
(5)设计以苯乙烯和丙酮为原料制备药物中间体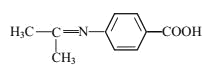 的合成路线__________(无机试剂自选)。
的合成路线__________(无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A的物质的量为2mol,B的物质的量为3mol;5min末测得C的物质的量为1.5mol,用D表示的化学反应速率
3C(g)+nD(g),开始时A的物质的量为2mol,B的物质的量为3mol;5min末测得C的物质的量为1.5mol,用D表示的化学反应速率![]() (D))为0.1mol·L-1·min-1。计算:
(D))为0.1mol·L-1·min-1。计算:
(1)前5min内用A表示的化学反应速率v(A)为__。
(2)化学方程式中n的值为__。
(3)此反应在四种不同情况下的反应速率分别为
①![]() (A)=1mol·L-1·s-1②
(A)=1mol·L-1·s-1②![]() (B)=4mol·L-1·min-1③
(B)=4mol·L-1·min-1③![]() (C)=3mol·L-1·min-1④
(C)=3mol·L-1·min-1④![]() (D)=7mol·L-1·min-1
(D)=7mol·L-1·min-1
其中反应速率最快的是__(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 molL-1s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 molL-1
其中正确的是
A.①④B.②③C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇(CH3CH2OH)既是生活中常见的有机物,又是重要的化工原料。
(1)工业上可用乙烯制备乙醇的化学方程式为:CH2 = CH2+H2O![]() CH3CH2OH,该反应属于____反应(填“加成”或“取代”)。
CH3CH2OH,该反应属于____反应(填“加成”或“取代”)。
(2)官能团决定有机物的性质。乙醇中含有的官能团名称是______。
(3)为探究乙醇的性质,某学生向试管中加入3mL乙醇,将下端绕成螺旋状的铜丝在酒精灯火焰上灼烧至红热后,迅速插入乙醇中,可观察到铜丝表面由黑色变成红色,说明乙醇具有______性。
(4)萃取是物质分离的一种方法。某学生拟用乙醇萃取溴水中的Br2,判断该方法是否可行:_____(填“是”或“否”),判断的理由是________。
(5)某液态有机物不溶于水,将它和水分离开来的方法是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.在酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2=I2+2H2O
C.向NaAlO2溶液中通入过量CO2:2AlO![]() +3H2O+CO2=2Al(OH)3↓+CO
+3H2O+CO2=2Al(OH)3↓+CO![]()
D.向稀HNO3中滴加Na2SO3溶液:SO![]() +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置探究硫酸与金属、非金属的反应、验证其产物,并探究随着反应的进行,硫酸性质发生的变化。根据实验要求回答相关问题:

F装置用于检验二氧化碳。供选择的试剂有:只含碳的生铁、18 mol·L-1的硫酸、品红溶液、无水硫酸铜粉未、酸性高锰酸钾溶液、氧化铜、澄清的石灰水、碱石灰。(供选择的试剂可重复使用)
(1)打开分液漏斗的活塞,A装置中发生的反应6H2SO4(浓)+2Fe![]() Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示)_____,随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)____
Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示)_____,随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)____
(2)B装置中的试剂是__________。
(3)E装置中的试剂是____________作用是______________。
(4)G装置中的试剂是__________,现象是______________。
(5)制备SO2的适宜药品为___________(填代号)。
①Na2SO3固体;②Na2SO3溶液;③20%硫酸;④70%硫酸;⑤铜片
(6)对SO2与氯水的反应进行探究。用注射器吸入一定量的饱和氯水和SO2,振荡,静置,再吸入少量品红溶液,发现品红溶液不褪色,用化学反应方程式解释其原因____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com