
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
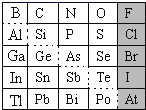
(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
②氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(2)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
【答案】< < B ![]() AB CaCO3固体 盐酸 NaHCO3溶液 Na2SiO3溶液 生成白色胶状沉淀
AB CaCO3固体 盐酸 NaHCO3溶液 Na2SiO3溶液 生成白色胶状沉淀
【解析】
(1) ①同周期元素从左到右非金属性增强,非金属越强最高价含氧酸的酸性越强,非金属性:Se>As,酸性:H3AsO4<H2SeO4,故答案为:<;
②同主族元素从上到下非金属性减弱,非金属性越强形成的气态氢化物还原性越弱,非金属性:O>S,则氢化物的还原性:H2O<H2S,故答案为:<;
(2)图中分界线(虚线部分)为金属与非金属的交界处,一般在附近寻找半导体材料,故答案为:B;
(3)①Se2Cl2常,Cl为-1价,则Se为+1价,具有过氧化氢的类似结构,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②A.由周期表结构可知,In在第五周期,Se在第四周期,原子的电子层数越多,半径越大,原子半径:In>Se,故A正确;
B.金属性从上到下逐渐增强,从左到右逐渐减弱,结合元素的位置可知,金属性:In>Te,Te>Se,因此In的金属性比Se强,故B正确;
C. Al和In同主族,同主族元素从上到下金属性增强,In的金属性比Al强,故C错误;
D.铟是第IIIA族,化合价为+3价,Se为第VIA族,化合价为-2价,硒化铟的化学式为In2Se3,故D错误;
故答案为:AB;
(4)设计实验比较C、Si的非金属性强弱顺序,应利用碳酸酸性强于硅酸证明,首先用盐酸与碳酸钙反应制取二氧化碳(不能选用硫酸与碳酸钙制取二氧化碳气体,因产生的硫酸钙微溶,会覆盖在碳酸钙表面影响反应进行),然后用碳酸氢钠溶液除去二氧化碳中混有的氯化氢,再将二氧化碳通入硅酸钠溶液中看是否出现白色胶状沉淀,
故答案为:CaCO3固体;盐酸;NaHCO3溶液;Na2SiO3溶液;生成白色胶状沉淀;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
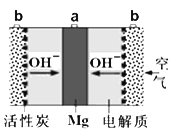
A. 电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B. 正极反应式为:Mg-2e-=Mg2+
C. 活性炭一极为正极
D. 电子的移动方向由a经外电路到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A.A和 B形成的化合物可作为耐火材料
B.A和C的氢化物的沸点:C>A
C.简单离子半径:E<D<C
D.E和D形成的化合物的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3。回答下列问题:
(1)E在元素周期表中的位置为_____________________________。
(2)比较B与C简单氢化物的热稳定性:_____> 。(填化学式)
(3)D,C两元素组成的化合物D2C2的电子式为_____________________,D2C2与水反应的化学方程式为 ______________________________________________。
(4)下列事实能说明元素F的非金属性比元素E的非金属性强的是______。
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.F2通入到D2E的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
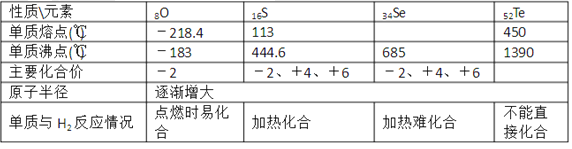
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年以来,世界多地发生了新冠病毒肺炎,威胁着人们的身体健康。抗击新冠肺炎疫情中,“84”消毒液、双氧水和“一次性口罩”起了非常重要的作用。下列正确的有( )
A.医用口罩中的过滤层所用的材料是熔喷聚丙烯,聚丙烯的结构可表示![]()
B.“84”消毒液的主要有效成分是NaClO,在NaClO固体中含有的化学键只有离子键
C.双氧水的结构式为 H-O-O-H,分子间可形成氢键
D.NaClO的电子式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
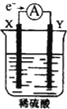
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种用来合成医药、农药的重要原料,某化学课外活动小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,在A下端活塞关闭的前提下,再将混合液慢慢滴入反应器A中。
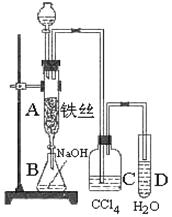
(1)写出A中反应的化学方程式_________________________________________________
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_____________________,C中盛放CCl4的作用是_______________________________________;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入______溶液,现象是_____________________________,则能证明;或者向试管D中加入______溶液,现象是_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com